Neutronidiffraktio ja jäänestoaineet: tutkimusta arktisista kaloista Understand article
Kääntänyt Johanna Kallio. Matthew Blakeley Blakeley ILL:ltä sekä hänen työtoverinsa muun muassa ESRF:ltä ovat selvittäneet, kuinka artiset kalat pysyvät hengissä verenkiertonsa sisältämän pakkasnesteen avulla lämpötilan laskiessa nolla alapuolelle. Matthew ja Eleanor Hayes…

scorpius) on myös
jäänestoproteiineja.
kuva julkisista lähteistä; kuvan
lähde: Wikimedia Commons
Arktisista seuduista mieleen tulevat jäävuoret, jääkarhut ja hylkeet. Hyytävät lämpötilat, jäätävä tuuli ja autiot lumikentät – melkoinen haaste mille tahansa elävälle olennoille.

pakottaneet elämet
kehittämään
sopeutumistapoja
Kuva ucumari; kuvan lähde:
Flickr
Arktiset eläimet sopeutuvat ympäristöönsä monin eri tavoin ja useat näistä tavoista ovat meille tuttuja: jääkarhujen paksu turkki, hylkeiden paksu rasvakerros, lintujen muutto. Nämä eläimet ovat kuitenkin kaikki endotermisiä – niiden ruumiinlämpötila on vakio ja hyvinkin ympäristön jäätävän lämpötilan yläpuolella.
Kalojen tilanne on hyvin erilainen – ne ovat enimmäkseen eksotermisiä, mikä tarkoittaa että niiden ruumiinlämpö on sama kuin ympäröivän veden. Ja vesi voi olla todella hyvin kylmä: Pohjoisen jäämeren lämpötila laskee jopa yhteen pakkasasteeseen ja sen jäätymisen estää vain veden korkea suolapitoisuus.
Kalojen veren, jossa on huomattavasti vähemmän suolaa, pitäisi jäätyä noin puolen asteen pakkasessa. Välttääkseen tämän arktiset kalalajit ovat kehittäneet erityisiä jäänestoproteiineja (AFP, antifreeze protein).

Flickr
AFP:illä on vaikea tehtävä. Estääksen kalaa jäätymästä kuoliaaksi, niiden on sidottava jääkiteiden alkioita veressä ja siten estettävä alkioden kehittyminen jääkiteiksi. Mutta miten AFP:t erottavat veden olomuodot, jään ja nesteen?
AFP:itä on tutkittu laajasti käyttäen useita tekniikoita, mukaanlukien röntgendiffraktio, ja nämä tutkimukset ovat paljastaneet erityisen jäätäsitovan pinnan olemassaolon.
Röntgendiffratktio perustuu röntgensäteen siroamiseen (diffraktioon) kunkin atomin elektronipilvestä. Monilla molekyyleillä on niille ominainen diffraktiokuvio. Atomit, kuten vety (ja deuterium), joilla on vain yksi elektroni, sirottavat kuitenkin röntgensäteilyä hyvin vähän (Kuva 1a, joten röntgendiffraktiosignaali vedelle (H2O) on hyvin samankaltainen kuin happiatomille (O). Tästä johtuen tutkijat eivät voineet tunnistaa kaikkia pinnan vesimolekyylejä, yrittäessään tutkia kuinka jäätäsitova pinta vuorovaikuttaaa jään kanssa.
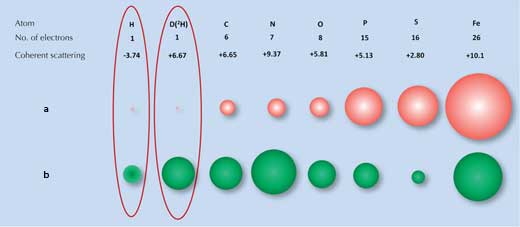
a) Röntgensäteet siroavat elektroneista, sironnan voimakkuus (punaisten pallojen koko) on suhteessa elektronien lukumäärään.
b) Neutronit siroavat atomiytimistä, sironnan voimakkuus (vihreiden pallojen koko) riippuu ytimen voimista.
Kuva Matthew Blakeley

amerikankivinilkan, Zoarces
americanus,
jäänestoproteiineja
Kuva Derek Keats; kuvan lähde:
Flickr
Tässä toinen tekniikka, neutronidiffraktio, osoittautui hyödylliseksi. Neutroneita sirottavat atomien ytimet, eivät elektronit, ja sironnan voimakkuus riippuu tietyistä ytimen voimista. Näihin voimiin puolestaan vaikuttavat paitsi alkuaineet myös alkuaineen isotoopit, jotka eroavat toisistaan atomiytimen neutronien lukumäärän suhteen (Kuva 1b, yllä). Onneksemme siis vetyatomit voidaan helpostin tunnistaa neutronisironnan avulla ja vedy isotooppi deuterium (raskas vety, jolla on ylimääräinen neutroni) voidaan tunnistaa vielä suuremmalla varmuudella. Näin veden signaali eroaa merkittävästi hapen signaalista.
Me (Matthew Blakeley ja hänen tutkijakollegansa) päätimme tutkia erästä AFP:tä arktisten kalojen veressä: tyypin III AFP:tä. Välttääksemme muiden tutkijoiden kohtaamat ongelmat, käytimme röntgen- ja neutronidiffraktion yhdistelmää tutkiaksemme proteiinin rakennetta ja sen vuorovaikutuksia vesimolekyylien kanssa. Kokeitamme varten käytimme Laue-Langevin Instituutin (Institute Laue-Langevin, ILL)w1 ja Euroopan Synkrotronisäteilylaitoksen (European Synchrotron Radiation Facility, ESRFw2; katso tarkemmat tiedot, alla) tutkimuslaitteita. Neutronitutkimuksen, kiteiden pienestä tilavuudesta huolimatta, mahdollisti ILL:n viime vuosien näytteenkäsittelyn ja laitteistojen kehitystyö.
Kuten tavanomaista tutkittaessa proteiinien rakenteita, lisäsimme tyypin II AFP:n synteettisen geenin Escherichia coliin, jossa proteiinia voitiin ylituottaa tarpeeksi suuri määrä tutkimusta varten. Bakteereja kasvatettiin raskaassa vedessä (joka sisälsi deuteriumia normaalien vetyjen sijaan), jotta tuottuva proteiini olisi perdeuteroitua: jokainen H-atomi olisi korvautunut deuteriumilla. Sitten kiteytimme proteiinin, jotta voisimme määrittää sen rakenteen ja tarkistaa samalla että perdeuteroidun proteiinin rakenne oli sama kuin normaalilla muodolla. (Katso Cornuéjols, 2009, ja Blattmann & Sticher, 2009 lukeaksesi lisää proteiinikristallografiasta ja jopa kokeillaksesi sitä itse.)
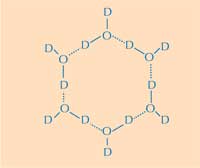
vesirengas. D = deuterium, O
= happi. Klikkaa kuvaa
suurentaaksesi
Kuva Nicola Graf
AFP:n rakenne eroaa tavanomaisista proteiinirakenteista, sillä normaalisti hydrofobisia aminohappoja on vain proteiinin ytimessä (kaukana ympäröivistä vesimolekyyleistä) ja pinnalla hydrofiilisiä aminohappoja. Tämä ero vastaa osittain kysymykseen, miten tyypin-III AFP erottaa jään vedestä. Kuten aiemmissa tutkimuksissa on osoitettu, AFP:illä on useita hydrofobisia aminohappoja proteiinin pinnalla, eikä vetysidosten muodostaminen nestemäisen veden kanssa ole mahdollista. Nämä hydrofobiset aminohapot muodostavat osan jäähän sitoutuvasta pinnasta, joka siis sitoutuu jääkiteiden alkioihin, ei veteen. Miten tämä toimii?
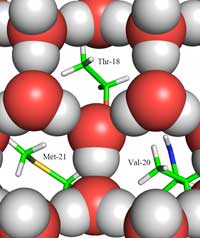
jään (punaiset ja harmaat
pallot) ja jäätäsitovan pinnan
välillä, hydrofobisten
aminohappotähteiden
(Thr-18, Val-20, Met-21)
metyyliryhmät osoittavat
kohti aukkoja jään
rakenteessa. Klikkaa kuvaa
suurentaaksesi
Copyright © 2011 John Wiley &
Sons, Ltd; kuvan lähde:
Howard et al. (2011)
Toisin sanoen, miten jään rakenne eroaa nestemäisen veden rakenteesta? Käyttäen neutronidiffraktiota saatoimme löytää vesimolekyylien paikat jäätäsitovalla pinnalla. Paikansimme tetraedrisen vesiryppään kiinnittyneenä jäätäsitovaan pintaan. Tämä tetraedrinen vesirypäs löytyy nestemäisestä vedestä (kuten meidän kokeessamme) mutta on myös tyypillinen jäälle; tämä antoi meille alkuasetelman mallittaaksemme loput jääkiteestä ja päätelläksemme miten se sitoutuu AFP:hen. Lopullinen mallimme koostuu kuusiosaisista vesirenkaista niinkutsutussa venekonformaatiossa: kuusi vesimolekyyliä järjestäytyneenä heksagonaalisesti siten että keskelle syntyy aukko (katso Kuva 2, yllä). Tämä aukko mahdollistaa sen että tyypin III AFP erottaa jääkiteen alkion rakenteen vedestä: hydrofobiset alueet jäätäsitovalla pinnalla sopivat näihin aukkoihin ja sitoutuvat Van der Waalsin voimilla (Kuva 3). Sitävastoin, nestemäisen veden rakenteessa ei ole aukkoja, joihin hydrofobiset alueet, kuten metyyliryhmät, voitaisiin sovittaa. Tämä estää suuren kontaktipinnan syntymisen nestemäisen veden ja jäätäsitovan pinnan välille ja näin tiukkaa vuorovaikutusta ei muodostu.

tapahtua arktisissa vesissä
ilman jäänestoproteiineja?
Kuva dwleindecker /
iStockphoto
Vaikka muut tutkijat ovat ehdottaneet hydrofobisille tähteille tärkeää roolia siinä miten tyypin III AFP:t tunnistavat jääkiteiden alkioita, tämän on ensimmäinen kokeellinen vahvistus olettamukselle.
On sinäänsä kiinnostavaa tietää enemmän siitä, miten arktiset kalat selviytyvät elinympäristössään, mutta tällä tutkimuksella on myös mahdollisia teollisia sovelluksia. Jo tällä hetkellä tyypin III AFP:tä lisätään jäätelöön, jotta jääkiteiden muodostus pysyisi minimissään ja jäätelön koostumus paranisi. Tulevaisuudessa AFP:tä koodaavia geenejä voidaan lisätä vaikkapa viljelykasveihin, jotta niitä voitaisiin kasvattaa pakkasessa.
Lisätietoja ILL:stä ja ESRF:stä

Laue-Langevin Instituutti (ILL)w1 on kansainvälinen tutkimuskeskus ja neutronitutkimuksen ja -teknologian huippuyksikkö. Se operoi yhtä maailman kirkkaimmista neutroniläheteistä, joka syöttää neutronisädettä 40:lle korkeatasoiselle laitteistolle, joita koko ajan rakennetaan paremmiksi.
Palveluinstituuttina ILL tarjoaa tutkimuslaitteistonsa ja osaamisensa vierailevien tutkijoiden käyttöön. Joka vuosi noin 1200 tutkijaa yli 30:stä maasta vierailee ILL:llä, Grenoblessa, Ranskassa. Yli 800 koetta suoritetaan vuosittain, lähinnä perustieteiden, kuten tiiviin aineen fysiikan, kemian, biologian, ydinfysiikan ja materiaalitieteen eri osa-alueilla.
Euroopan Synkrotronisäteilylaitos (The European Synchrotron Radiation Facility, ESRF)w2 on kansainvälinen tutkimuskeskus samalla alueella ILL:n kanssa, Grenoblessa, Ranskassa. Se tuottaa korkeaintensiteettistä röntgensäteilyä ja palvelee vuosittain tuhansia tutkijoita ympäri maailmaa.
Synkrotronien röntgensäteilyn ja neutronisäteen yhteiskäyttö voi auttaa ymmärtämään monimutkaisten systeemien toimintaa, kuten tässä artikkelissa kuvatut AFP:t. Jotta synkrotronien ja neutronitutkimuksen synergiasta voitaisiin saada paras mahdollinen hyöty, ESRF ja ILL ovat johtaneet partnerisopimusten muodostusta rakennebiologiassa (Partnership for Structural Biology, PSB) ja pehmeän tiiviin aineen tutkimuksessa (Partnership for Soft-Condensed Matter). Lisää sopimuksia luultavasti solmitaan lähiaikoina.
ILL ja ESRF ovat EIROforuminw3, Science in School-lehden julkaisijan, jäseniä.
References
- Blattmann B, Sticher P (2009) Growing crystals from protein. Science in School 11: 30-36.
- Cornuéjols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76.
- Howard EI, Blakeley MP et al. (2011) Neutron structure of type-III antifreeze protein allows the reconstruction of AFP–ice interface. Journal of Molecular Recognition 24: 724-732. doi: 10.1002/jmr.1130
Web References
- w1 – Lisätietoja ILL:stä, katso: www.ill.eu
- w2 – Lisätietoja ESRF:stä ja PSB:stä, katso www.esrf.eu ja www.psb-grenoble.eu
- w3 – Lisätietoja EIROforumista, katso: www.eiroforum.org
Institutions
Review
Jos olet joskus miettinyt, miten kalat selviytyvät merien kylmissä osissa, tästä artikkelista löydät vastauksen, joka johtaa lukijan läpi tieteellisen tutkimuksen proteiinien rakenteista ja niiden vuorovaikutuksista
Artikkelia voi käyttää tukimateriaalina biomolekyylejä opiskellessa tai keskustelun pohjana proteiinien roolista elävissä olennoissa . Sopivia kysymyksiä testaamaan ymmärrystä ovat esimerkiksi:
- Kuvaile miten arktiset kalat sopeutuvat jääkylmään Arktiseen meriveteen.
- Miten AFP:t toimivat pakkasnesteenä kalan verenkierrossa?
- Mitä rajotteita röntgendiffraktiotekniikalla on AFP:tä analysoitaessa?
- Miten neutronidiffraktio eroaa röntgendiffraktiosta?
- Kuvaile tutkimusvaiheet onnistuneessa AFP:n rakennemäärityksessä.
- Miten AFP:t eroavat muista proteiineista?
- Miten AFP:t erottavat jään nestemäisen veden molekyyleistä?
Angela Charles, Malta





