Supporting materials
Download
Download this article as a PDF

Ξεφεύγοντας από τα συνηθισμένα : Μάθετε για τη χημεία της καθίζησης και εισάγετε τους μαθητές σας στις χημικές αντιδράσεις που έχουν ως προϊόντα έγχρωμες ενώσεις, με τεχνικές μικροκλίμακας που είναι χαμηλού κόστους, γρήγορες και εύκολες στην εκτέλεσή τους.
Η ξαφνική εμφάνιση ιζημάτων μοιάζει μαγική στους μαθητές (και πολλοί τη θεωρούν μαγεία).[1] Δύο διαλύματα αλάτων αναμιγνύονται και ξαφνικά εμφανίζεται ένα στερεό. Κάποιες φορές το στερεό έχει διαφορετικό χρώμα από τα διαλύματα. Κατά την ανάμιξη διαλύματος θειικού χαλκού συγκέντρωσης 1 Μ με διάλυμα υδροξειδίου του νατρίου, θα εμφανιστεί ένα μπλε στερεό. Το στερεό είναι το υδροξείδιο του χαλκού, που είναι αδιάλυτο στον νερό. Αν χρησιμοποιηθεί διάλυμα νιτρικού μολύβδου ή νιτρικού αργύρου, τότε θα εμφανιστεί ξαφνικά ένα κίτρινο στερεό.
Στις παραδοσιακές τεχνικές που χρησιμοποιούνται δοκιμαστικοί σωλήνες γίνεται μεγάλη σπατάλη πόρων. Πολύ μεγάλες ποσότητες υλικών απορρίπτονται στον νιπτήρα ή αποθηκεύονται σε δοχεία συλλογής αποβλήτων. Σε προηγούμενο άρθρο σχετικό με τους δείκτες pH παρουσιάστηκε πως μπορούν οι δραστηριότητες να εκτελεστούν με τη βοήθεια ενός πλαστικού φύλλου. Οι οδηγίες τυπώνονται σε ένα φύλλο εργασίας, κάτω από την πλαστική επιφάνεια, περιορίζοντας την απόσπαση προσοχής. Αυτές οι δραστηριότητες είναι κατάλληλες για μαθητές ηλικίας 11 – 18.
Όταν οι μαθητές εκτελούν αντιδράσεις καταβύθισης ιζήματος, συχνά μπορεί να μη καταλάβουν από προέρχονται τα στερεά, καθώς δεν βλέπουν ποτέ να διαλύονται τα αρχικά άλατα. Η παρασκευή των διαλυμάτων από τους ίδιους τους μαθητές προσθέτει επιπλέον χρόνο στα μαθήματα. Αυτό το πείραμα σε μικροκλίμακα αποτελεί έναν γρήγορο και απλό τρόπο εισαγωγής στην έννοια της διαλυτότητας.
Σημείωση για την ασφάλεια : Τα διαλύματα είναι χαμηλού κινδύνου. Συνίσταται η χρήση προστατευτικών για τα μάτια, και τα χέρια θα πρέπει να πλένονται με σαπούνι και νερό μετά το πείραμα στην περίπτωση που έρθουν σε επαφή με τον χλωριούχο χαλκό (ΙΙ), που μπορεί να προκαλέσει ερεθισμό του δέρματος.

Τα αποτελέσματα επιτρέπουν σε μαθητές και εκπαιδευτικούς να συζητήσουν την προέλευση των χημικών ουσιών, και καθιστούν αξιόπιστη τη χημική εξίσωση:
CuCl2 + Na2CO3 → CuCO3 + 2NaCl
Η αντίδραση έχει αποτέλεσμα διότι το ανθρακικό νάτριο και ο χλωριούχος χαλκός είναι ευδιάλυτα στο νερό, ενώ ο ανθρακικός χαλκός δεν είναι τόσο διαλυτός, και γι’ αυτόν τον λόγο σχηματίζεται το ίζημα. Στην πραγματικότητα πρόκειται για ένα κορεσμένο διάλυμα ανθρακικού χαλκού στο νερό.
Όλοι οι μαθητές γνωρίζουν ότι το χλωριούχο νάτριο είναι διαλυτό στο νερό. Έτσι, οι μαθητές μπορούν τώρα να συμπληρώσουν έναν πίνακα αποτελεσμάτων και παρατηρήσεων.
| Άλατα διαλυτά στο νερό | Άλατα αδιάλυτα στο νερό |
|---|---|
| Χλωριούχος χαλκός Ανθρακικό νάτριο Χλωριούχο νάτριο | Ανθρακικός χαλκός |
Δοκιμάστε αντιδράσεις μεταξύ των ακόλουθων αλάτων:
Δεν θα σχηματιστεί ίζημα στη δεύτερη περίπτωση, που δείχνει ότι το νιτρικό νάτριο και το χλωριούχο κάλιο είναι επίσης διαλυτά στο νερό. Η πέμπτη αντίδραση είναι μία «πράσινη» αντίδραση καθώς τις χημικές ουσίες μπορεί κάποιος να τις προμηθευτεί από τα τοπικά καταστήματα. Η χρήση δοκιμαστικών σωλήνων συνεπάγεται πολύ χρόνο για καθαριότητα στο τέλος της δραστηριότητας. Τώρα με τη χρήση του πλαστικού φύλλου, η δραστηριότητα είναι γρήγορη, επιτρέποντας στον εκπαιδευτικό να έχει χρόνο για ανατροφοδότηση από τους μαθητές σχετική με τις παρατηρήσεις τους, με ελάχιστη παραγωγή αποβλήτων.
Η ταυτοποίηση των ιόντων των μετάλλων σε στερεά ή σε διαλύματα συγκέντρωσης 0.1 Μ μπορεί να γίνει αξιοποιώντας τεχνικές καταβύθισης. Η τεχνική της προσθήκης αντιδραστηρίων σε μία πλαστική επιφάνεια, με τις οδηγίες από κάτω, προσφέρεται ιδανικά για την μελέτη των μεταβατικών μετάλλων.
Σημείωση για την ασφάλεια : Τα διαλύματα είναι χαμηλού κινδύνου. Συνίσταται η χρήση προστατευτικών για τα μάτια, και τα χέρια θα πρέπει να πλένονται με σαπούνι και νερό μετά το πείραμα στην περίπτωση επαφής, καθώς τα διαλύματα των ιόντων των μεταβατικών μετάλλων μπορεί να προκαλέσουν ερεθισμό του δέρματος.

Η δραστηριότητα μπορεί να επεκταθεί στη μελέτη της χημείας των μεταβατικών μετάλλων (Φύλλο εργασίας 2), στη διάρκεια της οποίας μπορεί να παρατηρηθεί μία ποικιλία ωραίων χρωμάτων που οφείλονται στον σχηματισμό του υδροξειδίου του μεταβατικού μετάλλου κατά την προσθήκη διαλύματος υδροξειδίου του νατρίου 0.4 Μ σε διάλυμα ιόντων του μεταβατικού μετάλλου 0.1 Μ.

Η προσθήκη διαλύματος αμμωνίας 2 Μ μπορεί επίσης να δώσει ένα ευρύ φάσμα έγχρωμων ιζημάτων (Φύλλο εργασίας 3)

Η ταυτοποίηση των ανιόντων μπορεί επίσης να γίνει αξιοποιώντας τεχνικές καταβύθισης με την προσθήκη νιτρικού αργύρου.
Τα διαλύματα είναι χαμηλού κινδύνου. Συνίσταται η χρήση προστατευτικών για τα μάτια, και τα χέρια θα πρέπει να πλένονται με σαπούνι και νερό μετά το πείραμα στην περίπτωση επαφής, καθώς το διάλυμα του νιτρικού αργύρου μπορεί να προκαλέσει ερεθισμό του δέρματος.

Τα αποτελέσματα αναδεικνύουν ένα από τα δυνατά σημεία αυτής της τεχνικής. Μόνο τρία από τα έξι άλατα έδωσαν θετική αντίδραση με την προσθήκη διαλύματος νιτρικού αργύρου. Τα άλλα αρνητικά ιόντα δεν έδωσαν αντίδραση, καθώς η δοκιμή με τον νιτρικό άργυρο είναι μοναδική για τα αλογονίδια. Με την προσθήκη αμμωνίας 2 Μ, ο χλωριούχος άργυρος διαλύεται, ο βρωμιούχος άργυρος διαλύεται μερικώς, και ο ιωδιούχος άργυρος παραμένει αδιάλυτος.
Για την ανίχνευση ανθρακικών ιόντων σε ένα διάλυμα άλατος, προσθέστε 2 σταγόνες δείκτη pH, που θα φανερώσει ένα βασικό pH. Προσθέστε δύο σταγόνες υδροχλωρικού οξέος 0.4 Μ στο δείγμα. Θα σχηματιστούν φυσαλίδες διοξειδίου του άνθρακα. Για την δραστηριότητα αυτή θα αξιοποιηθεί η μεσαία σειρά του Φύλλου εργασίας 4.
Για την ανίχνευση θειικών ιόντων σε ένα διάλυμα άλατος, προσθέστε δύο σταγόνες υδροχλωρικού οξέος 0.4 Μ σε διάλυμα θειικού άλατος κάποιου μετάλλου (0.1 Μ), και στη συνέχεια δύο σταγόνες διαλύματος χλωριούχου βαρίου 0.1 Μ. Θα σχηματιστεί ένα λευκό ίζημα θειικού βαρίου. Για την δραστηριότητα αυτή θα αξιοποιηθεί η κάτω σειρά του Φύλλου εργασίας 4.
«Πέρσι κάναμε ιζήματα» είναι μία παρατήρηση που συχνά κάνουν κάποιοι μαθητές. Είναι σημαντικό οι εκπαιδευτικοί να έχουν κάτι νέο να παρουσιάσουν όχι μόνο για να τεκμηριώσουν ό,τι είχε διδαχθεί στο παρελθόν, αλλά και για να προσφέρουν νέες πληροφορίες, συμβάλλοντας στην περαιτέρω κατανόηση αυτών των αντιδράσεων. Η δραστηριότητα αυτή συνδυάζει διάλυση, διάχυση και καταβύθιση. Συνίσταται να πραγματοποιηθεί μετά την παρουσίαση της ιοντικής φύσης των αλάτων.
Σημείωση για την ασφάλεια : Τα στερεά είναι κυρίως χαμηλής επικινδυνότητας. Η χρήση ενώσεων κάποιων μετάλλων όπως του μόλυβδου, του κοβαλτίου και του νικελίου, μπορεί να έχει απαγορευτεί σε κάποιες χώρες. Οι αναγνώστες θα πρέπει να ακολουθούν πάντοτε τους τοπικούς κανόνες. Πάντως, ένα από τα πλεονεκτήματα των τεχνικών μικροκλίμακας είναι η ποσότητα της ουσίας που χρησιμοποιείται είναι τόσο μικρή που δεν είναι ικανή να προκαλέσει προβλήματα υγείας, και τα απόβλητα μπορούν να συλλεχθούν και να απορριφθούν. Συνίσταται η χρήση προστατευτικών για τα μάτια, και τα χέρια θα πρέπει να πλένονται με σαπούνι και νερό μετά το πείραμα στην περίπτωση επαφής.



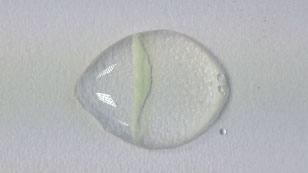

Συζητήστε τα ακόλουθα ερωτήματα με τους μαθητές σας:
Αν αξιοποιήσουμε την αντίδραση του νιτρικού αργύρου με το ιωδιούχο κάλιο ως παράδειγμα, θα διαπιστώσουμε ότι και οι δύο ουσίες είναι διαλυτές στο νερό. Πρόκειται για ιοντικές ενώσεις με δομή ιοντικού πλέγματος. Καθώς τα ιόντα απελευθερώνονται από το ιοντικό πλέγμα κατά τη διάλυση, τα ιόντα διαχέονται και μετακινούνται το ένα προς το άλλο έως ότου ένα ίζημα σχηματιστεί κοντά στο μέσο της διαδρομής. Το ίζημα που σχηματίζεται είναι ο ιωδιούχος άργυρος. Το άλλο διαλυτό προϊόν είναι το νιτρικό κάλιο.
Ένα προβολικό ή ένα ψηφιακό μικροσκόπιο είναι ιδανικά για υψηλής ευκρίνειας παρουσίαση στην τάξη.
[1] Worley B et al. (2019) Visualizing dissolution, ion mobility, and precipitation through a low-cost, rapid-reaction activity introducing microscale precipitation chemistry. Journal of Chemical Education 96: 951–954. doi: 10.1021/acs.jchemed.8b00563
Μία από τις ιδέες της βιώσιμης χημείας είναι ο περιορισμός των ποσοτήτων χημικών ουσιών που χρησιμοποιούνται. Άλλη είναι η μείωση των χημικών αποβλήτων. Η εκτέλεση πειραμάτων με μόνο λίγες σταγόνες σε μία πλαστική επιφάνεια είναι μία καλή ιδέα, και μπορούν να οδηγήσουν παρ’ όλα αυτά σε ενδιαφέρουσες παρατηρήσεις και ιδέες.
Ingo Eilks, καθηγητής Χημικής εκπαίδευσης στο Πανεπιστήμιο της Βρέμηςστη Γερμανία.
Download this article as a PDF