Μία τρύπα στον ουρανό Understand article
Μετάφραση από την Παρασκευή Θάνου (Paraskevi Thanou). Πριν από είκοσι πέντε χρόνια η ανακάλυψη της τρύπας στη στιβάδα του όζοντος κυριάρχησε στο προσκήνιο της…
Ανακαλύπτοντας την τρύπα
προσφέρθηκαν από the
Goddard Space Flight Center
Scientific Visualization Studio
Ήταν ένα τυχαίο εύρημα, όπως θυμάται ο Jonathan Shanklin, ένας από τους ανθρώπους που ανακάλυψαν την τρύπα: έχοντας γίνει μέλος της ομάδας της Βρετανικής Έρευνας για την Ανταρκτική (British Antarctic Survey)w1 το 1977, υποτίθεται ότι έπρεπε να ψηφιοποιήσει την πληθώρα των καταγεγραμμένων μετρήσεων του όζοντος – μέχρι τότε, χειρόγραφες σημειώσεις. Όπως αποδείχθηκε, αυτό περιελάμβανε και την κρίσιμη δεκαετία, τη δεκαετία του 1970, όταν τα επίπεδα του όζοντος άρχισαν να πέφτουν.
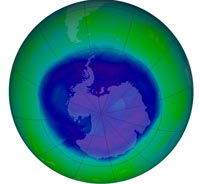
από την Ανταρκτική στο
ετήσιο μέγιστο στις 12
Σεπτεμβρίου 2008,
καταλαμβάνοντας πάνω
από 27 εκατομμύρια
τετραγωνικά χιλιόμετρα.
Αυτή θεωρείται μία μέτρια
μεγάλη τρύπα όζοντος,
σύμφωνα με τη NASA
Οι εικόνες προσφέρθηκαν από
NASA
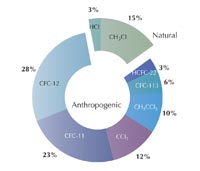
Ήδη υπήρχε αυξανόμενη ανησυχία ότι οι χλωροφθοράνθρακες (CFCs) – οργανικές ενώσεις, όπως το τριχλωροφθορομεθάνιο (CFCl3) και το διχλωροδιφθορομεθάνιο (CF2Cl2), που τότε χρησιμοποιούνταν ευρέως ως ψυκτικά υγρά, προωθητικά αέρια (στα σπρέι) και διαλύτες – ίσως κατέστρεφαν τη στιβάδα του όζοντος. Για μία ημέρα ελεύθερης προσέλευσης επισκεπτών το 1983, ο Shanklin ετοίμασε ένα γράφημα – ως ειρωνεία της τύχης, για να δείξει ότι οι τιμές του όζοντος δεν ήταν διαφορετικές από τις αντίστοιχες είκοσι χρόνων πριν. Παρόλο που αυτό ήταν αληθές για τα συνολικά επίπεδα του όζοντος, παρατήρησε ότι οι ανοιξιάτικες τιμές ήταν χαμηλότερες από τον ένα χρόνο στον άλλο. Περαιτέρω μελέτες το επιβεβαίωσαν και το 1985 ο Shanklin και οι συνεργάτες του Joe Farman και Brian Gardiner δημοσίευσαν τα ευρήματά τους: κάθε άνοιξη του νότιου ημισφαιρίου, μία τρύπα στη στιβάδα του όζοντος απλωνόταν πάνω από την Ανταρκτική, είχε προκληθεί πιθανώς από τους CFCs και αυξανόταν διαρκώς (Farman et al., 1985).
Ποια είναι η χημεία πίσω από αυτό το φαινόμενο και γιατί η τρύπα του όζοντος είναι τόσο επικίνδυνη;
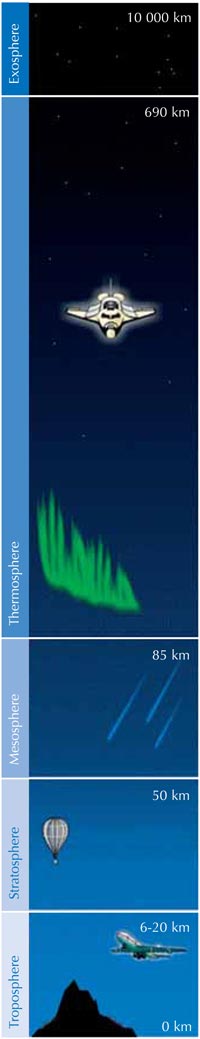
Το όζον στη στρατόσφαιρα
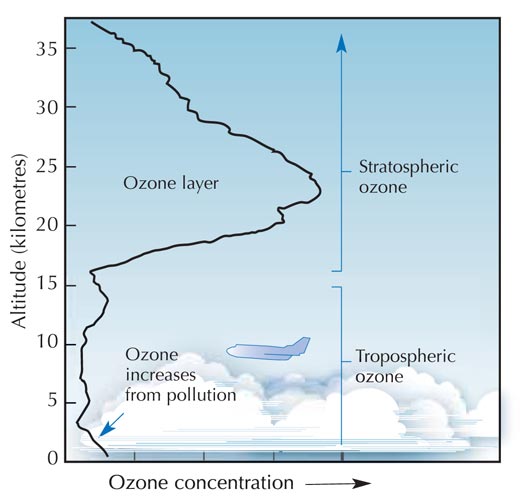
Το όζον (O3) είναι μια πολύ λιγότερο σταθερή τριατομική μορφή του οξυγόνου (O2). Είναι ένα ασθενώς γαλάζιο αέριο που περιέχεται σε χαμηλές συγκεντρώσεις σε όλη την ατμόσφαιρα – και ένα δίκοπο μαχαίρι: στην τροπόσφαιρα (βλ. εικόνα παρακάτω), το όζον είναι ένας ρυπαντής που μπορεί να προκαλέσει βλάβη στο αναπνευστικό σύστημα των ανθρώπων και άλλων ζώων και να καταστρέψει ευαίσθητα φυτά. Η στιβάδα του όζοντος στη στρατόσφαιρα, ωστόσο, είναι ευεργετική, παρεμποδίζοντας το μεγαλύτερο ποσοστό της επιβλαβούς υπεριώδους (UV) ηλιακής ακτινοβολίας να φτάσει στην επιφάνεια της Γης.
Η ταχύτητα σχηματισμού του όζοντος παίρνει τη μέγιστη τιμή της στη στρατόσφαιρα, τη δεύτερη υψομετρικά στιβάδα της γήινης ατμόσφαιρας (σε υψόμετρο περίπου 10-50 km; βλ. εικόνα), μέσω ενός φωτοχημικού μηχανισμού:
O2 + hν → O• + O• λ ~ 200 nm (1)
O• + O2 + M → O3 + M (2)
Εικόνα δημόσιας κυριότητας; πηγή εικόνας: Wikimedia Commons
Ένα μόριο οξυγόνου (O2) απορροφά ένα φωτόνιο UV ακτινοβολίας (hν) με μήκος κύματος (λ) περίπου 200 nm και διασπάται σε δύο άτομα οξυγόνου (O•) (αντίδραση 1). Το καθένα από αυτά συνδέεται στη συνέχεια με ένα άλλο μόριο οξυγόνου σχηματίζοντας όζον, αν η πίεση (Μ) είναι αρκετά υψηλή (περίπου ένα χιλιοστό μιας ατμόσφαιρας), ώστε να σταθεροποιηθεί το νεοσχηματισθέν μόριο του όζοντος (αντίδραση 2). Όσο μεγαλύτερο είναι το υψόμετρο, τόσο ταχύτερη είναι η αντίδραση 1 (κάτω από το υψόμετρο των 20 km, κανένα φωτόνιο με μήκος κύματος 200 nm δε φτάνει, γιατί όλα έχουν απορροφηθεί στην αντίδραση 1). Η ταχύτητα της αντίδρασης 2, ωστόσο, είναι μεγαλύτερη πιο κοντά στην επιφάνεια, όπου η ατμοσφαιρική πίεση είναι μεγαλύτερη. Ως αποτέλεσμα, η μέγιστη ποσότητα του όζοντος σχηματίζεται περίπου σε υψόμετρο 25 και 30 km (βλ. γράφημα).
H στρατόσφαιρα έχει δύο σημαντικές συνέπειες στη ζωή πάνω στη Γη. Πρώτον, το ίδιο το όζον απορροφά την υψηλής ενέργειας UV ακτινοβολία με μήκος κύματος περίπου 250 nm (αντίδραση 3):
O3 + hν → O• + O2 λ ~ 250 nm ΔH = – 90 kJ mol-1 (3)
Μεταξύ αυτών, το οξυγόνο (αντίδραση 1) και το όζον (αντίδραση 3) φιλτράρουν επομένως το μεγαλύτερο ποσοστό της μικρού μήκους κύματος UV ακτινοβολίας μεταξύ 200 και 300 nm, η οποία διαφορετικά θα ήταν πολύ επιζήμια για τη ζωή πάνω στη Γη.
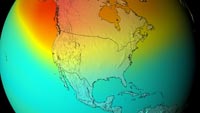
Δεύτερον, η αντίδραση 3 παράγει μεγάλο ποσό θερμότητας, οπότε η στρατόσφαιρα είναι μια θερμότερη στιβάδα από ό,τι το ανώτερο μέρος της τροπόσφαιρας (βλ. εικόνα αριστερά), κι έτσι ο καιρός στην τροπόσφαιρα είναι λιγότερο ακραίος από ό,τι θα ήταν διαφορετικά.
Μέσω των αντιδράσεων 2 και 3 τα άτομα οξυγόνου και το όζον αλληλομετατρέπονται ταχύτατα. Υπάρχει όμως μία άλλη αργή αντίδραση, η οποία είναι γνωστό ότι καταστρέφει και τα άτομα οξυγόνου και το όζον, και συγκεκριμένα η αντίδραση μεταξύ αυτών των δύο ουσιών:
O• + O3 → O2 + O2 (4)
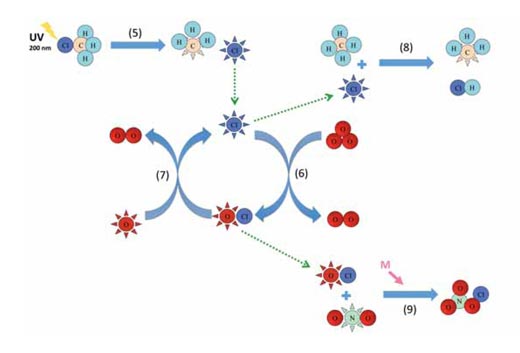
Οι αντιδράσεις 1-4 συνοψίζονται στο παρακάτω διάγραμμα.
Οι εικόνες προσφέρθηκαν από Marlene Rau
Φυσικοί καταλυτικοί κύκλοι ελαττώνουν τα επίπεδα του όζοντος
Το 1995, οι Paul Crutzen, Mario Molina και F. Sherwood Rowland κέρδισαν το Βραβείο Νόμπελ Χημείας για την εργασία τους στο σχηματισμό και τη διάσπαση του όζοντος στη στρατόσφαιρα. Τι είχαν μάθει; Τη δεκαετία του 1970, οι Crutzen κ.α. ανακάλυψαν την ύπαρξη φυσικών καταλυτικών κύκλων που επιταχύνουν την αντίδραση 4 και μειώνουν την ποσότητα του όζοντος στη στρατόσφαιρα (Crutzen, 1970, 1971): νερό (H2O), μεθάνιο (CH4), μονοξείδιο του διαζώτου (N2O) και χλωρομεθάνιο (CH3Cl) απελευθερώνονται στην ατμόσφαιρα μέσω βιολογικών διεργασιών, που συμβαίνουν στην επιφάνεια της Γης, και οδηγούν στο σχηματισμό ελευθέρων ριζών, όπως το υδροξύλιο (OH•), το μονοξείδιο του αζώτου (NO•) και το ατομικό χλώριο (Cl•), τα οποία καταλύουν τη διάσπαση του όζοντος.

Οι εικόνες προσφέρθηκαν από Marlene Rau
Η αντίδραση 5 δείχνει πώς το χλωρομεθάνιο απελευθερώνει ελεύθερες ρίζες ατομικού χλωρίου στη στρατόσφαιρα μέσω της φωτόλυσης, και οι αντιδράσεις 6 και 7 είναι ένα παράδειγμα καταλυτικού κύκλου (βλ. το διάγραμμα παραπάνω). Οι αντιδράσεις των άλλων καταλυτών είναι ανάλογες των αντιδράσεων 6 και 7. Το χλωρομεθάνιο απελευθερώνεται μερικώς και από θαλάσσιους και από χερσαίους οργανισμούς, όπως ερυθρά μακροφύκη, μύκητες λευκής σήψης και ανώτερα φυτά, ώστε να ρυθμίσουν τα επίπεδα των ιόντων χλωρίου στα κύτταρα, και – μετά από 30 έως 40 χρόνια – μπορεί να φτάσει την ανώτερη στρατόσφαιρα (σε υψόμετρο περίπου 40 km), όπου διασπάται υπό την επίδραση του ηλιακού φωτός (φωτόλυση):
CH3Cl + hν → •CH3 + Cl• l ~ 200 nm (5)
Η σχηματιζόμενη ελεύθερη ρίζα ατομικού χλωρίου (Cl•) μπορεί στη συνέχεια να συμμετάσχει σε έναν καταλυτικό κύκλο:
Cl• + O3 → ClO• + O2 (6)
ClO• + O• → Cl• + O2 (7)
Οι αντιδράσεις 6 και 7 συνολικά είναι ουσιαστικά ισοδύναμες της αντίδρασης 4, αλλά γίνονται πολύ ταχύτερα – στην περίπτωση του κύκλου των ριζών του ατομικού χλωρίου / μονοξειδίου του χλωρίου (ClO•), περίπου 30 000 φορές γρηγορότερα. Επομένως, γιατί αυτοί οι καταλυτικοί κύκλοι δεν καταστρέφουν όλο το όζον; Η απάντηση βρίσκεται στον τερματισμό αυτών των κύκλων μέσω του σχηματισμού σταθερών μορίων:
Cl• + CH4 → •CH3 + HCl (8)
ClO• + •NO2 + M → ClONO2 + M (9)
Τελικά, μια ελεύθερη ρίζα ατομικού χλωρίου θα συναντήσει ένα μόριο μεθανίου και θα αντιδράσει σχηματίζοντας υδροχλώριο (HCl, αντίδραση 8). Παρόμοια, μια ρίζα μονοξειδίου του χλωρίου, θα ενωθεί με μια ρίζα διοξειδίου του αζώτου, σχηματίζοντας νιτρικό χλώριο (ClONO2, αντίδραση 9) – άλλη μια εξαρτώμενη από την πίεση αντίδραση, που επομένως λειτουργεί καλύτερα σε χαμηλότερο υψόμετρο. Και το υδροχλώριο και το νιτρικό χλώριο είναι πολύ σταθερά και η απομάκρυνση των ριζών του ατομικού χλωρίου και του μονοξειδίου του χλωρίου σταματά τελικά τον καταλυτικό κύκλο.
Ο γρίφος της τρύπας του όζοντος πάνω από την Ανταρκτική
στρατόσφαιρα σύμφωνα με
την «Επιστημονική
Αξιολόγηση της Ελάττωσης
του Όζοντος: 1998», του
WMO / UNEP. Κάντε κλικ
στην εικόνα για μεγέθυνση
Οι εικόνες προσφέρθηκαν από
Andrew Ryzhkov; πηγή
εικόνας: Wikimedia Commons
Οι επιστήμονες δεν άργησαν να συνειδητοποιήσουν ότι οι CFCs μπορούσαν να ενεργοποιήσουν έναν παρόμοιο καταλυτικό κύκλο αποικοδόμησης του όζοντος: το 1974, οι Molina και Rowland όχι μόνο προειδοποίησαν ότι τα επίπεδα των CFCs συνέχιζαν να αυξάνονται χωρίς ρύθμιση, αλλά επίσης προέβλεψαν ότι οι CFCs θα προκαλούσαν μια σημαντική επιπρόσθετη απώλεια όζοντος σε υψόμετρο περίπου 40 km (βλ. Molina & Rowland, 1974). Ωστόσο, όταν η τρύπα του όζοντος ανακαλύφθηκε τελικά το 1985, ήταν στην πραγματικότητα σε υψόμετρο περίπου 20 km, πάνω από το Νότιο Πόλο την άνοιξη του νότιου ημισφαιρίου (βλ. Farman et al., 1985).
Αμέσως έγινε αντιληπτό ότι οι ελεύθερες ρίζες ατομικού χλωρίου από τους CFCs ήταν υπεύθυνες, αλλά πολλές ερωτήσεις παρέμεναν αναπάντητες. Γιατί η τρύπα εμφανίστηκε πάνω από τον Πόλο; Αφού εμφανίστηκε πάνω από το Νότιο Πόλο, γιατί δεν εμφανίστηκε και πάνω από το Βόρειο Πόλο; Γιατί μόνο την άνοιξη; Και γιατί η τρύπα του όζοντος υπήρχε σε υψόμετρο 20 km αντί 40 km, όπως αρχικά είχε προβλεφθεί; Εξάλλου, οι CFCs δεν μπορούσαν να διασπαστούν από το ηλιακό φως σε υψόμετρο τόσο χαμηλό όσο των 20 km, αφού η πυκνότητα των φωτονίων ήταν ανεπαρκής. Για τον ίδιο λόγο, δεν παράγονται αρκετά άτομα οξυγόνου σε αυτό το υψόμετρο, ώστε να πραγματοποιηθεί η αντίδραση 7. Πολλά χρόνια περαιτέρω μελέτης αποκάλυψαν ολόκληρη την ιστορία.

Οι εικόνες προσφέρθηκαν από Dudley Shallcross, Tim Harrison, Marlene Rau και Nicola Graf
Πρώτον, οι ελεύθερες ρίζες ατομικού χλωρίου, που απελευθερώνονται από τους CFCs, π.χ
CFCl3 + hν → •CFCl2 + Cl• l ~ 200 nm (10)
μπορούν να αντιδράσουν με το μεθάνιο (αντίδραση 8) σχηματίζοντας υδροχλώριο ή με το όζον (αντίδραση 6) σχηματίζοντας ρίζες μονοξειδίου του χλωρίου, και μέσω της αντίδρασης 9 μπορούν στη συνέχεια να σχηματίσουν νιτρικό χλώριο. Αυτή η ακολουθία αντιδράσεων θα προκαλούσε αύξηση στις συγκεντρώσεις του υδροχλωρίου και του νιτρικού χλωρίου σε υψόμετρο περίπου 40 km παγκοσμίως.
την επιφάνεια της Γης προς το
διάστημα
Εικόνα δημόσιας κυριότητας;
πηγή εικόνας: Wikimedia Commons
Κάθε χειμώνα του νότιου ημισφαιρίου, ο Νότιος Πόλος βυθίζεται στο σκοτάδι για τρεις μήνες περίπου. Ο αέρας στη στρατόσφαιρα πάνω από το Νότιο Πόλο ψύχεται. Χωρίς υπεριώδη ακτινοβολία, η αντίδραση 3 δε λαμβάνει χώρα, και έτσι δεν απελευθερώνεται θερμότητα. Ο αέρας κατέρχεται και η περιστροφή της Γης τον εξαναγκάζει να περιστρέφεται σχηματίζοντας μία δίνη, όπως το νερό όταν αδειάζει ο νιπτήρας. Αυτή η δίνη είναι τόσο ισχυρή, ώστε αέρας από το εξωτερικό να μην μπορεί να εισέλθει και αέρας από το εσωτερικό να μην μπορεί να εξέλθει. Ο αέρας που είναι πλούσιος σε υδροχλώριο και νιτρικό χλώριο στο υψόμετρο των 40 km παρασύρεται προς τα κάτω σε αυτή την ψυχρή και σκοτεινή δίνη.
Στις ακραίες συνθήκες ψύχους του πολικού χειμώνα, ο αέρας σε αυτή τη δίνη γίνεται τόσο ψυχρός, ώστε κάτω από τους -78°C (195 K) και σε ένα υψόμετρο 15-25 km, πολικά στρατοσφαιρικά νέφη σχηματίζονται από κρυστάλλους νερού και / ή οξέων.
Το πρώτο παράξενο χημικό φαινόμενο είναι ότι το υδροχλώριο και το νιτρικό χλώριο μπορούν να προσροφηθούν στα πολικά στρατοσφαιρικά νέφη και να υποστούν μία ταχεία ετερογενή αντίδραση από την αέρια στη στερεή φάση, παράγοντας νιτρικό οξύ (HNO3) που ενσωματώνεται στους κρυστάλλους πάγου, ενώ το μοριακό χλώριο (Cl2) απελευθερώνεται πάλι στην αέρια φάση.
HCl + ClONO2 → HNO3 + Cl2 πολικά στρατοσφαιρικά νέφη (11)
Αυτή η αντίδραση μπορεί να λαμβάνει χώρα όλο το χειμώνα, εάν έχει αρκετό κρύο ώστε να σχηματιστούν τα πολικά στρατοσφαιρικά νέφη. Όταν η ηλιοφάνεια επιστρέφει την άνοιξη, υπάρχει πληθώρα μορίων χλωρίου σε υψόμετρο περίπου 15-25 km, τα οποία φωτολύονται παράγοντας ρίζες ατομικού χλωρίου:
Cl2 + hν → Cl• + Cl• l ~ 350 nm (12)
και στη συνέχεια ρίζες μονοξειδίου του χλωρίου μέσω της αντίδρασης 6.
Ωστόσο, κατά την πολική άνοιξη, η αντίδραση 7 (ο σχηματισμός των ριζών χλωρίου και των μορίων οξυγόνου από τις ρίζες μονοξειδίου του χλωρίου και οξυγόνου) είναι πολύ αργή, αφού υπάρχουν πολύ λίγα άτομα οξυγόνου, λόγω της έλλειψης φωτονίων 200 nm σε αυτό το υψόμετρο, και εδώ είναι που συμβαίνει το δεύτερο παράδοξο χημικό φαινόμενο. Σε χαμηλές θερμοκρασίες, όπως στην πολική δίνη – που είναι πολύ ψυχρή, ακόμα και την άνοιξη – οι ρίζες μονοξειδίου του χλωρίου μπορούν να σχηματίσουν ένα διμερές, το υπεροξείδιο του χλωρίου (ClOOCl):
ClO• + ClO• → ClOOCl (13)
Αυτό το διμερές είναι ασταθές σε θερμοκρασία δωματίου, αλλά αρκετά σταθερό σε χαμηλές θερμοκρασίες (κάτω των -30 °C) και μπορεί να φωτολυθεί:
ClOOCl + hν → Cl• + O2 + Cl• l ~ 300 nm (14)
Έτσι, παρόλο που η αντίδραση 7 δε συμβαίνει, η αντίδραση 14 παρέχει μία οδό αναγέννησης των ελευθέρων ριζών ατομικού χλωρίου με τη βοήθεια του φωτός, και ο καταλυτικός κύκλος της καταστροφής του όζοντος μπορεί να ξεκινήσει τώρα που επιστρέφει η ηλιοφάνεια.
Σε τι διαφέρει αυτό από τους φυσικούς καταλυτικούς κύκλους που είδαμε πριν – γιατί υπάρχει πλήρης απομάκρυνση του όζοντος σε κάποιο υψόμετρο σε αυτή τη δίνη; Πρώτον, η αντίδραση 8 (η οποία απομακρύνει τις ρίζες χλωρίου και μπορεί να τερματίσει τον κύκλο) είναι πολύ αργή στις χαμηλές θερμοκρασίες που επικρατούν στη δίνη, και επομένως αναποτελεσματική. Δεύτερον, όλο το διοξείδιο του αζώτου που απαιτείται για την αντίδραση 9 (η οποία όμοια θα τερμάτιζε τον κύκλο, μέσω του σχηματισμού του ClONO2) έχει μετατραπεί σε νιτρικό οξύ κατά τη διάρκεια του χειμώνα (π.χ. μέσω των αντιδράσεων 9 και 11) και δεν μπορεί να αναπληρωθεί, αφού δεν υπάρχει ανοδικό ρεύμα αέρα στη δίνη (στη βάση της δίνης, ο αέρας ρέει από το Νότιο Πόλο προς τον Ισημερινό, όπου η ανοδική ροή λαμβάνει χώρα). Επομένως ο κύκλος συνεχίζεται ανενόχλητος και καταστρέφει όλο το όζον σε αυτό το επίπεδο. Τελικά, χωρίς όζον, η αντίδραση 3, που διαφορετικά θα θέρμαινε αυτή την περιοχή, δεν πραγματοποιείται και έτσι η δίνη διατηρείται κατά τη διάρκεια της άνοιξης, επιδεινώνοντας την καταστροφή του όζοντος.

νέφη στο Asker, Νορβηγία
Εικόνα δημόσιας κυριότητας;
πηγή εικόνας: Wikimedia
Commons
Ο μόνος λόγος που η τρύπα του όζοντος είναι πιο έντονη πάνω από το Νότιο Πόλο από ό,τι πάνω από το Βόρειο, είναι ότι οι εαρινές θερμοκρασίες στη στρατόσφαιρα πάνω από το Βόρειο Πόλο είναι ελαφρώς μεγαλύτερες από αυτές της στρατόσφαιρας πάνω από το Νότιο Πόλο, γιατί υπάρχουν περισσότερες οροσειρές στα μεσαία έως μεγάλα γεωγραφικά πλάτη του βόρειου ημισφαιρίου, που μεταβάλλουν τη δυναμική της ατμοσφαιρικής ροής, με αποτέλεσμα να υπάρχουν λιγότερα πολικά στρατοσφαιρικά νέφη.
Αργά την άνοιξη, η ροή του πλούσιου σε όζον αέρα από επάνω θερμαίνει τελικά τη δίνη μέσω της αντίδρασης 3, επιτρέποντας στη δίνη να διαλυθεί. Εφόσον η ανταλλαγή με άλλα μέρη της ατμόσφαιρας γίνεται πάλι δυνατή, η τρύπα του όζοντος γεμίζει με όζον από τον περιβάλλοντα αέρα.
Σε μερικά χρόνια, η τρύπα του όζοντος πάνω από την Ανταρκτική απλώθηκε τόσο πολύ, που έφτασε στην Αυστραλία, τη Νέα Ζηλανδία, τη Χιλή και την Αργεντινή, φτάνοντας μιάμιση φορά το μέγεθος των ΗΠΑ. Και όταν η τρύπα του όζοντος καταστρέφεται, ο ελλειμματικός σε όζον αέρας μετακινείται σε γειτονικές (κατοικημένες) περιοχές, συμπεριλαμβανομένης και της Νότιας Αφρικής. Για τους ανθρώπους σε αυτές τις περιοχές, η τρύπα του όζοντος αποτελεί μια άμεση απειλή της υγείας. Η κύρια ανησυχία είναι η αυξημένη έκθεση στην UV ακτινοβολία, που μπορεί να προκαλέσει καρκίνο του δέρματος και καταρράκτη στα μάτια, καθώς επίσης και βλάβη στο ανοσοποιητικό σύστημα. Επιπλέον, υπερβολική έκθεση στην UV ακτινοβολία προκαλεί βλάβες στα φυτά και στα οικοδομικά υλικά.
Οι CFCs και το όζον σήμερα
Σήμερα, έχουμε κατανοήσει σε ικανοποιητικό βαθμό τις φυσικές και χημικές διεργασίες που κυριαρχούν στη στιβάδα του όζοντος.
Από τη στιγμή που έγινε εμφανής ο πραγματικός αντίκτυπος των CFCs στην καταστροφή του όζοντος, οι κυβερνήσεις υιοθέτησαν κανονισμούς για να σταματήσουν τη χρήση των CFCs, αντικαθιστώντας τους με εναλλακτικές, περιορισμένης ζωής, ουσίες (υδροφθοράνθρακες και υδροχλωροφθοράνθρακες), οι οποίες όμως τελικά επίσης καταργήθηκαν: Το Πρωτόκολλο του Μόντρεαλ του 1987 και ειδικά οι τροποποιήσεις του το 1990 και το 1992, που επιτάχυναν την κατάργηση, ήταν μια περιβαλλοντική επιτυχία.
Τα πιο πρόσφατα δεδομένα από το AGAGE (the Advanced Global Atmospheric Gases Experiment)w2, , το οποίο παρακολουθεί τα επίπεδα των CFCs και των αντικαταστατών τους από το 1978, δείχνουν ότι ακόμα και τα ατμοσφαιρικά επίπεδα του διχλωροδιφθορομεθανίου (CF2Cl2), του μεγαλύτερης διάρκειας ζωής χλωροφθοράνθρακα, τώρα μειώνονται: η νομοθεσία ήταν αποτελεσματική (αριστερά). Μία τρύπα στη στιβάδα του όζοντος συνεχίζει να σχηματίζεται κάθε άνοιξη πάνω από το Νότιο Πόλο, αλλά εκτιμάται ότι έως το 2050 αυτό δε θα συμβαίνει πλέον, και ότι έως το 2080 το παγκόσμιο όζον θα επιστρέψει στα επίπεδα της δεκαετίας του 1950.
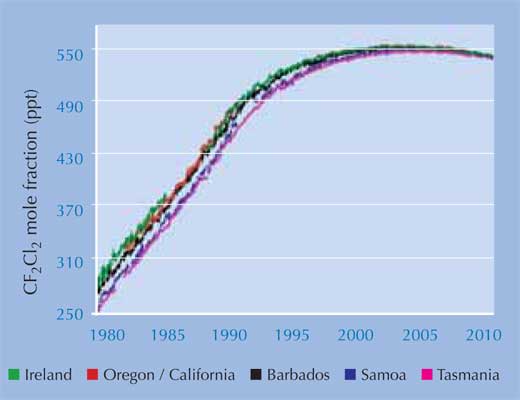
Οι εικόνες προσφέρθηκαν από the AGAGE project
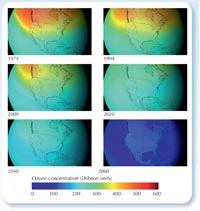
όζοντος, αν δεν είχαν
απαγορευθεί οι CFCs. Κάντε
κλικ στην εικόνα για
μεγέθυνση
NASA Οι εικόνες
προσφέρθηκαν από the
Goddard Space Flight Center
Scientific Visualization Studio
Η τρύπα του όζοντος είναι το αποτέλεσμα μιας αυξημένης χρήσης των CFCs, η οποία ξεκίνησε τη δεκαετία του 1930 – όπως οποιοδήποτε άλλο αέριο, οι CFCs χρειάζονται 30-40 χρόνια για να φτάσουν την ανώτερη στρατόσφαιρα, που σημαίνει ότι υπάρχει μια αντίστοιχη καθυστέρηση στην επίπτωση που έχουν στη στιβάδα του όζοντος. Αυτή τη στιγμή βιώνουμε το μέγιστο των επιπέδων του χλωρίου στη στρατόσφαιρα, ως αποτέλεσμα της μεγάλης χρήσης των CFCs κατά τη δεκαετία του 1980 – οπότε το μέγιστο μέγεθος, που έχει η τρύπα του όζοντος κάθε χρόνο, θα πρέπει να αρχίσει να μειώνεται σε λίγα χρόνια από τώρα.
Παρόλο που η ανάκαμψη είναι αργή, σίγουρα σταματήσαμε μια καταστροφή: οι επιστήμονες έχουν υπολογίσει ότι αν η χρήση των CFCs είχε συνεχιστεί με τον ετήσιο ρυθμό αύξησης 3% της δεκαετίας του 1970, αυτό θα είχε οδηγήσει σε μια παγκόσμια τρύπα του όζοντος έως το 2060, με όλα τα προβλήματα υγείας που θα επέφερε (Newman et al., 2009).
Ίσως το πιο σημαντικό μάθημα που πρέπει να πάρουμε από την τρύπα του όζοντος είναι το πόσο γρήγορα ο πλανήτης μας μπορεί να αλλάξει από την ανθρώπινη επίδραση – κυρίως προς το χειρότερο, αλλά επίσης και προς το καλύτερο – και ότι η αλλαγή είναι δυνατή, αν δράσουμε συντονισμένα, αποτελεσματικά και γρήγορα.
References
- Crutzen PJ (1970) Influence of nitrogen oxides on atmospheric ozone content. Quarterly Journal of the Royal Meteorological Society 96: 320-325. doi: 10.1002/qj.49709640815
- Crutzen PJ (1971) Ozone production rates in an oxygen-hydrogen-nitrogen oxide atmosphere. Journal of Geophysical Research 76(30): 7311-7327. doi: 10.1029/JC076i030p07311
- Farman JC, Gardner BG, Shanklin JD (1985) Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction. Nature 315: 207-210. doi: 10.1038/315207a0
-
Το άρθρο είναι ελεύθερα προσβάσιμο στην ιστοσελίδα του περιοδικούNature (www.nature.com) ή μέσω του άμεσου συνδέσμου: http://tinyurl.com/2wemxhn
-
- Molina MJ, Rowland FS (1974) Stratospheric sink for chlorofluoromethanes – chlorine atomic-catalysed destruction of ozone. Nature 249: 810-812. doi:10.1038/249810a0
-
Το άρθρο είναι ελεύθερα προσβάσιμο στην ιστοσελίδα του περιοδικούNature (www.nature.com) ή μέσω του άμεσου συνδέσμου: http://tinyurl.com/2u69cul
-
- Newman PA et al. (2009) What would have happened to the ozone layer if chlorofluorocarbons (CFCs) had not been regulated? Atmospheric Chemistry and Physics 9: 2113-2118. doi: 10.5194/acp-9-2113-2009
- Patterson L (2010) A chemical bond: Nick Barker, linking schools and universities in the UK. Science in School 15.
- Veneu-Lumb F, Costa M (2010) Using news in the science classroom. Science in School 15: 30-33.
Web References
- w1 –Η Βρετανική Έρευνα για την Ανταρκτική (British Antarctic Survey) είναι υπεύθυνη για τις βρετανικές επιστημονικές δραστηριότητες στην Ανταρκτική. Δείτε: www.antarctica.ac.uk
- w2 – Το πρόγραμμα Advanced Global Atmospheric Gases Experiment, AGAGE, είναι μια πρωτοβουλία χρηματοδοτούμενη από τη NASA, η οποία καταγράφει τη σύσταση της παγκόσμιας ατμόσφαιρας συνεχώς από το 1978, συμπεριλαμβανομένων των CFCs και των περισσότερων αερίων του φαινομένου του θερμοκηπίου εκτός του CO2, όπως καθορίστηκε στο Πρωτόκολλο του Κυότο. Για να έχετε πρόσβαση στα δεδομένα και για περισσότερες πληροφορίες, δείτε:http://agage.eas.gatech.edu
Resources
- O Sidney Chapman ήταν ο πρώτος που πρότεινε το φωτολυτικό μηχανισμό, μέσω του οποίου σχηματίζεται και διασπάται το όζον. Δείτε:
-
Chapman S (1930) On ozone and atomic oxygen in the upper atmosphere.Philosophical Magazine Series 7 10(64): 369-383.
-
- Ο Jonathan Shanklin, ένας από τους επιστήμονες που ανακάλυψαν την τρύπα του όζοντος, δημοσίευσε τις σκέψεις του 25 χρόνια μετά την ανακάλυψη:
-
Shanklin J (2010) Reflections on the ozone hole. Nature 465: 34-35. doi: 10.1038/465034a
-
Κατεβάστε το άρθρο δωρεάν εδώ, ή γίνετε συνδρομητές στο Natureσήμερα: www.nature.com/subscribe
-
- Το Nature έχει δημοσιεύσει επίσης μια συλλογή άρθρων που έχουν βοηθήσει στην κατανόηση της στρατόσφαιρας και της στιβάδας του όζοντος, ή έχουν περιγράψει την ιστορία της ανακάλυψης, μερικά από τα οποία είναι διαθέσιμα ελεύθερα. Δείτε: www.nature.com/nature/focus/ozonehole
- Η σελίδα παρακολούθησης της τρύπας του όζοντος της NASA προσφέρει ιστορικούς χάρτες του όζοντος, δεδομένα για το όζον, ένα σύνολο πολυμέσων σχετικών με το όζον, μια συλλογή εκπαιδευτικών ενοτήτων για θέματα σχετικά με το όζον και άλλα. Δείτε: http://ozonewatch.gsfc.nasa.gov
- Το Πανεπιστήμιο του Cambridge, Ηνωμένο Βασίλειο, έχει δημιουργήσει μια εικονική περιήγηση στην τρύπα του όζοντος, την ιστορία της και την επιστήμη σχετικά με αυτή. Η περιήγηση είναι διαθέσιμη στα Αγγλικά, Γαλλικά και Γερμανικά. Δείτε: www.atm.ch.cam.ac.uk/tour
- Οι 74 επιστήμονες που παρακολούθησαν τη συνάντηση επιτροπής αναθεώρησης για την αξιολόγηση του όζοντος το 2002 στο Les Diablerets, Ελβετία, δημοσίευσαν 20 Ερωτήσεις και Απαντήσεις για τη Στιβάδα του Όζοντος, συμπεριλαμβανομένης της συμβολής των κύκλων της ηλιακής δραστηριότητας και των ηφαιστειακών εκρήξεων. Δείτε: www.gcrio.org ή χρησιμοποιήστε τον άμεσο σύνδεσμο: http://tinyurl.com/2wpvf9r
- Το βιβλίο Εισαγωγή στην Ατμοσφαιρική Χημεία (Introduction to Atmospheric Chemistry) του Καθηγητή του Πανεπιστημίου του Harvard Daniel J Jacob, που είναι ελεύθερα προσβάσιμο ως αρχείο PDF, περιλαμβάνει μια ενότητα για το όζον, συμπεριλαμβανομένου του διαγράμματος «Χρονικό της τρύπας του όζοντος» (κεφάλαιο 10.3.3). Δείτε: http://acmg.seas.harvard.edu/people ή χρησιμοποιήστε τον άμεσο σύνδεσμο: http://tinyurl.com/39vhy6a
- Το Ozzy Ozone είναι μια ιστοσελίδα του Περιβαλλοντικού Προγράμματος των Ηνωμένων Εθνών που προσφέρει cartoons, παιχνίδια, γλωσσάριο και άλλα – συμπεριλαμβανομένων και εκπαιδευτικών πακέτων διαθέσιμων για κατέβασμα με εγχειρίδια για το μαθητή και το δάσκαλο, τόσο για την πρωτοβάθμια όσο και για τη δευτεροβάθμια εκπαίδευση. Όλο το υλικό είναι διαθέσιμο στα αγγλικά, γαλλικά και ισπανικά. Δείτε: www.ozzyozone.org
- Η ιστοσελίδα για την καταστροφή του όζοντος του επιστήμονα και συγγραφέα Rod Jenkins περιέχει περιεκτικές πληροφορίες: www.ozonedepletion.info
- Η ιστοσελίδα του Περιβαλλοντικού Προγράμματος των Ηνωμένων Εθνών OzonAction παρέχει μια ευρεία συλλογή δεδομένων και πληροφοριών για το όζον και το Πρωτόκολλο του Μόντρεαλ. Δείτε: www.unep.fr/ozonaction
-
Δείτε επίσης τις σελίδες του Περιβαλλοντικού Προγράμματος των Ηνωμένων Εθνών για το όζον στα αγγλικά, γαλλικά και ισπανικά: http://ozone.unep.org
-
- Η NASA προσφέρει δύο online videos της εξέλιξης της ατμόσφαιρας πάνω από την Αρκτική, όπως καταγράφηκαν από τον Ερευνητικό Δορυφόρο Ανώτερης Ατμόσφαιρας (Upper Atmosphere Research Satellite, UARS).
-
Μπορείτε να παρακολουθήσετε την αυξανόμενη συγκέντρωση του νιτρικού χλωρίου την περίοδο Φεβρουαρίου / Μαρτίου 1993. Δείτε www.nasaimages.org ή χρησιμοποιήστε τον άμεσο σύνδεσμο:http://tinyurl.com/2w6wgh4
-
Αυτό το video δείχνει το σχηματισμό των πολικών στρατοσφαιρικών νεφών. Δείτε: www.nasaimages.org ή χρησιμοποιήστε τον άμεσο σύνδεσμο www.nasaimages.org ή χρησιμοποιήστε τον άμεσο σύνδεσμο: http://tinyurl.com/33dfn6e
-
- Επιπλέον, η NASA έχει δημοσιεύσει εικόνες της τρύπας του όζοντος κατά τη διάρκεια ενός κύκλου ζωής της. Δείτε: www.nasa.gov/vision/earth/lookingatearth/25TOMSAGU.html
Review
Η τρύπα του όζοντος είναι ένα επίκαιρο και παγκόσμιο θέμα και θα βρείτε αυτό το άρθρο πραγματικά χρήσιμο για να το κατανοήσετε. Οι χημικές διεργασίες που εμπλέκονται περιγράφονται με λεπτομέρεια. Στα μαθήματα χημείας, το άρθρο μπορεί να χρησιμοποιηθεί για τη διδασκαλία της ατομικής δομής και των χημικών δεσμών, των ελευθέρων ριζών, των καταλυτικών κύκλων και της επίδρασης του φωτός και της θερμοκρασίας στις χημικές αντιδράσεις.
Για το μάθημα των γεωεπιστημών, το άρθρο θα μπορούσε να χρησιμοποιηθεί στο πλαίσιο των παρακάτω θεμάτων:
- Επίδραση της ατμόσφαιρας στο κλίμα
- Βιολογικές διεργασίες που συμβαίνουν στην επιφάνεια της Γης και επηρεάζουν τους θαλάσσιους οργανισμούς
- Μορφολογία της Γης και κατανομή των οροσειρών στην επιφάνεια της Γης
- Η αλλαγή των εποχών, η κλίση του άξονα της Γης και η περιστροφή.
Υπάρχει η δυνατότητα για διαθεματική εργασία που συνδέει τη χημεία με τις γεωεπιστήμες. Πιθανά θέματα περιλαμβάνουν:
- Η γεωγραφική κατανομή των οργανισμών που παράγουν χημικές ουσίες, οι οποίες συμμετέχουν στους φυσικούς καταλυτικούς κύκλους. Πού ζουν αυτοί οι οργανισμοί; Ποιες χημικές ουσίες παράγουν;
- Η χημική σύνθεση της ατμόσφαιρας και η επίδρασή της στο κλίμα. Από ποια αέρια αποτελείται η ατμόσφαιρα; Με ποιον τρόπο καθορίζουν οι ιδιότητες της ατμόσφαιρας τις κλιματικές συνθήκες στην επιφάνεια της Γης και πώς αυτό διαφέρει σε άλλους πλανήτες;
Το άρθρο θα μπορούσε να αποτελέσει επίσης τη βάση ενός μαθήματος για τον τρόπο, με τον οποίο η επιστήμη παρουσιάζεται στα μέσα ενημέρωσης. Οι μαθητές θα μπορούσαν να συγκρίνουν αυτό το άρθρο με τα αντίστοιχα στο γενικό τύπο: προβάλλουν τα τελευταία μια ισορροπημένη άποψη, αναφέροντας και τα χημικά και τα φυσικά συστατικά που οδηγούν στο σχηματισμό της τρύπας του όζοντος; Υποτιμούν ή δίνουν υπερβολική έμφαση στο φαινόμενο στο σύνολό του; Γιατί – λόγω της άγνοιας των δημοσιογράφων, της πολιτικής στρατηγικής ή και των δύο; Για περισσότερες ιδέες στη χρήση των ειδήσεων στο μάθημα, δείτε Veneu-Lumb & Costa (2010).
Τέλος, το κείμενο είναι κατάλληλο ως βάση για ασκήσεις κατανόησης. Πιθανές ερωτήσεις είναι:
- Γιατί αυτό το θέμα είναι ένα πολυσυζητημένο ερώτημα σήμερα;
- Ποιος είναι ο ρόλος των φυσικών παραγόντων στην αύξηση της τρύπας του όζοντος; Τι ισχύει για τους ανθρωπογενείς παράγοντες;
Teresa Celestino, Ιταλία





