Materiezustände & Phasenübergänge Teach article
Erforsche Phasenübergänge zwischen verschiedenen Aggregatzuständen durch eine Reihe ansprechender praktischer Experimente.

Materie kommt in verschiedenen Zuständen vor: fest, flüssig, gasförmig und in Form von Plasma. Wenn sich die äußeren Bedingungen (wie Temperatur oder Druck) ändern, kann sich auch der Zustand der Materie ändern. Zum Beispiel wird eine Flüssigkeit wie Wasser zu einem Gas, wenn sie auf ihren Siedepunkt erhitzt wird, oder sie beginnt zu gefrieren, wenn sie auf ihren Gefrierpunkt abgekühlt wird. Ein Zustand der Materie mit sehr hoher Energie ist das Plasma. Hier sind einige der Orbital-Elektronen nicht mehr an Atome oder Moleküle gebunden. Das Plasma ist also ein Gas aus freien Elektronen und Ionen.
Phasenübergänge kommen in der Natur häufig vor, werden aber auch technologisch oft genutzt. Insbesondere sind mehrere Teilchendetektoren auf Phasenübergänge angewiesen. Außerdem kann die Hochenergiephysik-Forschung einen noch energiereicheren Zustand der Materie erzeugen, das sogenannte Quark-Gluon-Plasma.
Daher bietet die Hochenergiephysik einen ergiebigen und spannenden Kontext, um mit Schülerinnen und Schülern Materiezustände und Phasenübergänge zu diskutieren. Mehrere spannende Experimente eignen sich außerdem dafür, dass Schülerinnen und Schülern die Phänomene selbst untersuchen können. Im Folgenden stellen wir einige unserer Lieblingsexperimente vor und erläutern die Verbindung mit der Physik und den Technologien des CERN. Wenn Sie diese Experimente mit Schülerinnen und Schülern durchführen, lassen Sie sie das Ergebnis des Experiments vorhersagen, bevor sie es durchführen und das Ergebnis beobachten.
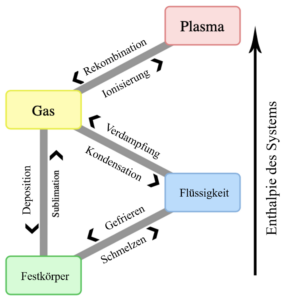
Verdampfung – flüssig zu gasförmig
Wenn Wasser bis zu seinem Siedepunkt erhitzt wird, bilden sich Blasen aus Wasserdampf, da das Wasser vom flüssigen in den gasförmigen Zustand übergeht. In ähnlicher Weise beginnen sich beim Öffnen einer Flasche Sprudelwasser Blasen zu bilden. Hier setzt der durch das Öffnen des Deckels verursachte Druckabfall den Verdampfungsprozess in Gang.
Ein interessanter Effekt ist an Oberflächen zu beobachten, die winzige Unreinheiten aufweisen, zum Beispiel Zellulosefasern im Inneren eines Glases. Diese bieten Ausgangspunkte für die Bildung von Blasen, sogenannte Keimbildungsstellen. Beim Einfüllen von Sprudelwasser in ein Glas werden kleine Gasmengen in oder um kleine Staubpartikel wie Zellulosefasern eingeschlossen.
Ein sehr ähnliches Prinzip liegt der Blasenkammer-Partikel-Detektionstechnik zugrunde. Blasenkammern sind mit einer überhitzten Flüssigkeit gefüllt, die einen großen Drang hat, zu einem Gas zu werden. Daher wird jede kleine Störung oder Verunreinigung den Prozess der Blasenbildung innerhalb einer Blasenkammer in Gang setzen. Wenn ionisierende Teilchen durch diese überhitzte Flüssigkeit fliegen, ionisieren sie die Moleküle auf ihrem Weg. Diese Ionen wirken dann als Keimstellen und es bilden sich Blasen um sie herum. Auf diese Weise kann die Spur eines ionisierenden Teilchens, das eine Spur von Ionen hinterlässt, sichtbar gemacht werden, wenn man im richtigen Moment Fotos von den Blasenbahnen macht. (Mehr über Blasenkammern erfährst du here.)
Heute werden Blasenkammern nicht mehr für die Forschung am CERN verwendet. Allerdings haben sie in letzter Zeit eine neue Rolle in der Dunkle-Materie-Forschung gefunden, zum Beispiel im PICO project in Canada.
Practical experimentation with evaporation: dancing raisins in bubbling water

Eines unserer Lieblingsexperimente ist das „tanzende Rosinen-Experiment“, mit dem die Schüler die Rolle von Keimbildungsstellen in sprudelndem Wasser untersuchen können.
Material
- Ein Glas
- Sprudelwasser (oder ein anderes sprudelndes und transparentes Getränk)
- Einige Rosinen
Durchführung
- Fülle das Glas mit der sprudelnden Flüssigkeit.
- Gebe einige Rosinen dazu.
- Beobachte die Rosinen und achte besonders auf ihre Bewegungen.
Modifikationsmöglichkeiten
- Du kannst auch andere potenzielle „Tänzer“ oder andere sprudelnde Flüssigkeiten ausprobieren, zum Beispiel unterschiedliche Nudeln, gefrorene Heidelbeeren, Linsen, Mais usw. Versuche die beste Kombination zu finden.
- Gebe die Rosinen direkt in eine Flasche Sprudelwasser und vergleiche ihre Bewegungen mit und ohne Deckel.
Erklärung
Die Rosinen werden schnell anfangen, sich im sprudelnden Wasser auf und ab bewegen. Warum? Die Oberfläche der Rosinen ist nicht so flach wie die Oberfläche des Glases. Stattdessen enthält die Oberfläche der Rosinen viele winzige Fasern, die als Keimbildungsstellen dienen. Dadurch bilden sich an der Oberfläche der Rosinen winzige Bläschen aus Kohlendioxidgas. Wenn sich genügend Gasbläschen an der Oberfläche einer Rosine anlagern, beginnt diese nach oben zu steigen (Auftrieb, archimedisches Prinzip). Sobald die Rosinen die Oberseite erreichen, platzen die Blasen, weil sie der Luft ausgesetzt sind. Ohne ihre „Schwimmhilfen“ sinken die Rosinen wieder.
Schmelzen – fest zu flüssig
Wenn die innere Energie eines Stoffes zunimmt, z. B. durch Anwendung von Wärme oder Druck, wird ein Feststoff zu einer Flüssigkeit. So beginnen Eiswürfel oder eine Wachskerze bei Wärmezufuhr zu schmelzen, wobei der Druck konstant bleibt. Feststoffe wie Eis oder Wachs unterscheiden sich jedoch in ihrem Schmelzpunkt. Während Eis bei einer Temperatur von etwa 0 °C schmilzt, schmilzt Wachs bei etwa 40 °C. Wenn ein Stoff seinen Schmelzpunkt erreicht hat, steigt die Temperatur des Stoffes auch bei konstanter Wärmezufuhr nicht weiter an, solange noch etwas Feststoff zum Schmelzen vorhanden ist. Daher wird die zum Schmelzen eines Festkörpers zugeführte Wärme auch als latente Wärme bezeichnet. Erst wenn der gesamte Feststoff in einen flüssigen Zustand übergegangen ist, beginnt die Temperatur wieder zu steigen.
Praktisches Experimentieren zum Schmelzvorgang: ein kühlendes Bad
Unter all den Experimenten, in denen Schüler den Schmelzprozess untersuchen können, ist die Herstellung eines Kühlbades vielleicht das coolste. Doch Scherz beiseite, es ist wirklich beeindruckend! Darüber hinaus ist die Kühlung für den Betrieb des LHC unerlässlich. Auf der CERN-Webseite zur Kryogenik findest du weitere Informationen.
Die Mindesttemperatur eines normalen Eis-Wasser-Gemisches ist der Schmelzpunkt von Eis bei 0 °C. Ein solches Gemisch eignet sich als Kühlbad, z. B. zum Kühlen einer Flasche Limonade. Es gibt jedoch einen Trick, um das Kühlbad noch kühler zu machen und die Limonade noch effizienter zu kühlen. Der Schmelzpunkt einer Substanz wie Eis kann durch Zugabe eines Salzes wie Natriumchlorid herabgesetzt werden. Ein Eis-Wasser-Salz-Gemisch hat also am Ende eine niedrigere Temperatur als ein Eis-Wasser-Gemisch.
Material

- Kaltes Wasser
- Salz
- Zerstoßendes Eis (alterativ: Eiswürfel, Plastikbeutel und Hammer), das Salz:Eis-Verhältnis muss 1:3 betragen
- Thermometer (alternativ: Multimeter mit Temperatursensor, bis -20 °C)
- 600 mL Becherglas
- 400 mL Becherglas
- Löffel
Sicherheitshinweis
- Verwende ein kälteresistentes Glas.
- Jüngere Schülerinnen und Schüler dürfen bei Versuchen mit Kühlbädern nicht allein gelassen werden.
Durchführung
- Stelle das 400 mL Becherglas in das 600 mL Becherglas, um einen isolierenden Behälter zu erhalten.
- Gebe zerstoßendes Eis in das innere Becherglas.
- Füge genug kaltes Wasser hinzu um das Eis zu bedecken.
- Messe die Temperatur der Wasser-Eis-Mischung (sie sollte bei etwa 0 °C liegen).
- Gebe Salz hinzu (zur Erinnerung, das Salz:Eis-Verhältnis muss 1:3 betragen).
- Rühre die Mischung bis das Eis schmilzt.
- Messe die Temperatur der Wasser-Eis-Salz-Mischung (sie sollte bei bis zu -20 °C liegen).
Praktisches Experimentieren zum Schmelzvorgang: Auftrieb von Eis
Ein weiteres spannendes Experiment ist die Untersuchung, wie schmelzende Eisberge den Meeresspiegel beeinflussen oder wie schmelzende Eiswürfel den Pegel eines zuckerhaltigen Sommergetränks beeinflussen.
Da Salz- (oder Zucker-) Wasser dichter ist als Wasser, ist die auf Eis ausgeübte Auftriebskraft größer. Daher sinken Eiswürfel in Salz- (oder Zucker-) Wasser nicht so stark ab, wie sie es in Wasser tun würden. Deshalb steigt der Pegel des Salz- (oder Zucker-) Wassers, wenn die Eiswürfel schmelzen, während er bei Wasser gleich bleibt. Dieser Effekt tritt beispielsweise auf, wenn Eiswürfel in einem zuckerhaltigen Sommergetränk schmelzen. Leider werden dadurch auch die negativen Auswirkungen des Klimawandels verstärkt: Eisberge sind große Eisbrocken, die von Gletschern (z. B. in Grönland) abbrechen. Sie bestehen aus Wasser, nicht aus Salzwasser. Der Meeresspiegel steigt also nicht nur, wenn Eisberge ins Meer treiben, sondern auch, wenn sie schmelzen.
Material

- Kaltes Wasser
- Salz (oder Zucker)
- 6 Eiswürfel
- zwei 50 mL Becherglas
- Löffel
Durchführung
- Fülle die zwei Bechergläser zur Hälfte mit Wasser.
- Füge 3-4 Teelöffel Salz (oder Zucker) in eines der Bechergläser und rühre.
- Gebe 3 Eiswürfel in beide Bechergläser.
- Gebe Wasser zu dem Salz- (oder Zucker) Wasser, bis der Flüssigkeitsstand in beiden Bechergläsern gleich ist, und rühre.
- Markiere den Flüssigkeitsstand bei beiden Bechergläsern.
- Warte bis die Eiswürfel geschmolzen sind.
Weitere Informationen
Man kann auch beobachten, dass die Eiswürfel in Salz- (oder Zucker-) Wasser langsamer schmelzen als in Wasser. Dies ist eine weitere Folge der höheren Dichte von Salz- (oder Zucker-) Wasser im Vergleich zu Wasser.
Wusstest du, dass sich das CERN für die Sustainable Development Goals engagiert? Erfahre mehr darüber, wie das CERN zu einem besseren Planeten beiträgt, auf der Wissenstransfer-Website des CERN.
Kondensation – gasförmig zu flüssig
Die Nebelkammer war einer der ersten Teilchendetektoren. Dabei ist der wichtigste Aspekt ein unterkühlter, übersättigter Alkoholdampf, der im Wesentlichen ein sehr kaltes und sehr feuchtes Gas ist, das eine große Neigung hat flüssig zu werden. Jede Störung dieses Dampfes kann den Kondensationsprozess auslösen. Wenn hochenergetische, ionisierende Teilchen durch diese Dampfschicht fliegen, hinterlassen sie eine Spur von Ionen. Diese Ionen lösen dann den Kondensationsprozess aus und wirken als Kondensationskerne. So wird aus der Ionenspur eine Spur von kleinen Tropfen, die man bei den richtigen Lichtverhältnissen mit dem Auge oder einer Kamera beobachten kann. Dieses relativ einfache Prinzip machte es Teilchenphysikern schon vor 100 Jahren möglich, Teilchenspuren aufzuzeichnen.
Heute untersucht das CLOUD-Experiment am CERN die Wolkenbildung, um mehr über den Klimawandel herauszufinden. Interessiert? Sieh dir eine TEDEd-Lektion von Kirby, Richer, & Comes (2016) an: Cloudy climate change: How clouds affect Earth‘s temperature (Wolkiger Klimawandel: Wie Wolken die Temperatur der Erde beeinflussen).
Praktisches Experimentieren zur Kondensation: eine Wolke in der Flasche
Es gibt mehrere Experimente, mit denen Schülerinnen und Schüler die Kondensation untersuchen können. Das Wolke-in-der-Flasche-Experiment zeigt auf eindrucksvolle Weise, wie ein schneller Druckabfall den Phasenübergang Kondensation auslösen kann. Im Internet gibt es mehrere Videos und Anleitungen hierzu. Je nach Aufwand und Ausrüstung ist der Effekt schon bei einer Demonstration beeindruckend zu beobachten oder als praktisches Experiment einfach und sicher selbst durchzuführen. Daher stellen wir im Folgenden unsere beiden Lieblingsmethoden vor. Wenn Sie Zugang zu Trockeneis haben, können Sie Ihre Schüler bauch ihre eigene Nebelkammer mit Trockeneis und Isopropanol-Alkohol bauen lassen.

1. Eindrucksvolle Demonstration
Material
- 30 mL Desinfektionsmittel (etwa 70% Alkohol oder reiner Alkohol)
- Eine Flasche Druckluft
- Eine 1 L transparente PET-Flasche
- Wasser und Mehl
Sicherheitshinweis
- Trage eine Schutzbrille, um deine Augen gegen Alkoholspritzer und eine unvorhergesehene Ausdehnung der PET-Flasche zu schützen.
- Trage außerdem Schutzhandschuhe, um deine Haut vor dem Alkohol zu schützen, insbesondere falls du reinen Alkohol verwendest.
Durchführung
- Mache ein kleines Loch in den Deckel der Flasche und drücke das Röhrchen der Druckluftflasche hinein.
- Verwende eine Mehl-Wasser-Mischung, um die Öffnung abzudichten (Alternativen sind Klebeband, Knetmasse, Kleber …).
- Gebe 30 mL Desinfektionsmittel (oder Alkohol) in die PET-Flasche und drehe die Flasche um, damit die innere Oberfläche mit Alkohol benetzt ist.
- Setze den Deckel auf und achte darauf, dass alle Verbindungen luftdicht abschließen.
- Gebe 20 Sprühstöße Druckluft in die verschlossene Flasche.
- Öffne vorsichtig den Deckel (Achtung, es hat sich Druck aufgebaut!).
- Nun solltest du eine sehr dichte Wolke aus Alkoholtropfen in der Flasche sehen.
Modifikationen
- Du kannst auch eine Ball- oder Fahrradpumpe verwenden, um den Druck in der Flasche aufzubauen – allerdings musst du dann vielleicht einige zusätzliche Kondensationskerne hinzufügen.
- Zur Verwendung von zusätzlichen Kondensationskernen: Öffne den Deckel, drücke die Flasche zusammen und blase ein Streichholz vor der Öffnung aus, lass die Flasche los, damit so einige Rauchpartikel eingesogen werden (der Rauch stellt dann die zusätzlichen Kondensationskerne dar).
- Dies gelingt auch mit Wasser statt mit Alkohol, allerdings weniger eindrucksvoll.
2. Einfaches praktisches Experiment
Material
- 10 mL Desinfektionsmittel (etwa 70% Alkohol oder reiner Alkohol)
- Eine 0,5 L transparente PET-Flasche
- Ein Streichholz
Sicherheitshinweis
- Trage eine Schutzbrille, um deine Augen gegen Alkoholspritzer zu schützen.
- Trage außerdem Schutzhandschuhe, um deine Haut vor dem Alkohol zu schützen. besonders wenn du sehr reinen Alkohol verwendest.
- Schülerinnen und Schüler dürfen während der Durchführung nicht allein gelassen werden.
- Bei jüngeren Schülerinnen und Schülern darf nur der Tutor oder die Tutorin sowie der Lehrer oder die Lehrerin das Streichholz verwenden, damit die Schülerinnen und Schüler nicht versehentlich den Alkohol in der Flasche in Brand setzen.
Durchführung
- Gebe Desinfektionsmittel (oder reinen Alkohol) in die PET-Flasche.
- Verschließe die Flasche mit ihrem Deckel.
- Drehe die Flasche, damit die innere Oberfläche mit Alkohol benetzt ist.
- Öffne den Deckel und drücke die Flasche leicht zusammen. Blase nun ein Streichholz vor der Öffnung aus.
- Lasse die Flasche los, sodass einige Rauchpartikel eingesogen werden (der Rauch wird einige zusätzliche Kondensationskerne darstellen).
- Schließe den Deckel.
- Drücke die Flasche so fest du kannst und lasse sie dann schlagartig los.
- Nun solltest du eine Wolke in der Flasche erscheinen sehen.
Danksagungen
Dieser Artikel wurde ursprünglich als ein CERN-Lernmodul veröffentlicht.
References
The melting of ice floating on the sea introduces a volume of water that is about 2.6% larger than that of the originally displaced seawater: Noerdlinger PD, Brower KR (2007) The melting of floating ice raises the ocean level . Geophysical Journal International , 170: 145-150. doi: 10.1111 / j.1365-246X.2007.03472.x
Resources
- Das Video zum Rosinen-Experiment ist auf Twitter und Facebook verfügbar.
- Auf der Seite der CERN CDS Videos kann das Video zum Rosinen-Experiment heruntergeladen werden.
- Materiezustände und Superkühlung: Ein Überblick.
- Weitere Experimente zu Phasenübergängen und Materiezuständen.





