Потъмняващото наследство на ван Гог Understand article
Превод Емилия Мурзова. Брилянтно жълтите краски в картините на ван Гог се превръщат в отблъскващо кафяви. Andrew Brown разкрива как това може да бъде обяснено…
Заедно с експанзивния маниер на нанасяне на боите, изборът на Винсент ван Гог (1853 – 1890) на живи и често нереалистечни цветове, с които да поредаде настроение или емоция, са били водещи в уникалния му стил, оказал мощно влияние върху развитието на модерната живопис. Пигментите от новото поколение на 19ти век са позволили на ван Гог да създаде например наситеното жълто на знаменитите му Слънчогледи (Sunflowers). Тези поразяващи нюанси, използвани в много от работите на художника, съдържат новите пигменти, наречени хромово жълто. За съжаление повече от 100 години след като е било нанесено от четката на ван Гог, хромовото жълто на места видимо е потъмняло до поразително кафяво, феномен, привлякъл наскоро вниманието на група учени.

С любезното съдействие на Van Gogh Museum, Amsterdam

С любезното съдействие на Van Gogh Museum, Amsterdam

С любезното съдействие на Acacia217; източник: Wikimedia Commons

С любезното съдействие на Van Gogh Museum, Amsterdam
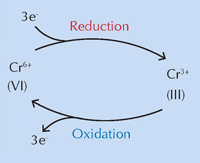
Международен екип, под ръководството на Коен Янсенс от Университета в Антверп, Белгия, вярва, че химичните промени в хромното жълто (PbCrO4 · xPbO), настъпили под въздействието на ултравиолетова светлина (UV), са причината за промяната на цвета (Monico et al., 2011). Това че пигментът потъмнява на слънчева светлина, е известно от създаването му. Изследвания от 50те години показват, че причината е редукцията на хрома от Cr(VI) до Cr(III) (виж фиг. 1 по-долу). Досега обаче точният механизъм не е известен, както и не са описани продуктите на реакцията.
С любезното съдействие на Nicola Graf
Историческите туби с боя
За да проучи тези неясноти, екипът на Янсенс започна със събиране на мостри от тубите с бои, принадлежали на съвременника на ван Гог, фламандския художник Рик Вутърс (1882-1913). Някои от тубите съдържали все още несмесено хромно жълто, докато в други имало по-светло жълта боя, получена от смесването на хромно жълто с бяло. Изследователите подложили мострите на изкуствено стареене под действието на UV светлина, очаквайки да наблюдават промяна на цвета след няколко месеца. За тяхно учудване обаче, само след три седмици, тънкия повърхностен слой от светло жълта боя бил потъмнял чувствително да шоколадова кафяво. Несмесените мостри или не били променени, или се променили съвсем незначително. „Бяхме изумени”, споделя Янсенс.

След като установяват, че в мострата най-вероятно е протекла фаталната химична реакция, екипът сапочнал сложни анализи, базиращи се на рентгеновите лъчения. По-голямата част от изследванията са проведени European Synchrotron Radiation Facility (ESRF)w1 в Гренобъл, Франция, като са използвани две техники – XRF и XANES, които с висока точност определят пространственото разположение и степента на окисление на избрати елементи от мострата боя (виж карето).
Анализите показали, че потъмняването на тънкия повърхностен слой пигмент се дължи на редукция на хрома в хромното жълта от Cr(VI) до Cr(III); а това съвпада с наблюдаваното при индустриалните бои на базата на оловен хромат. Освен това, Cr(III)-съдържащият продукт на реакцията е идентифициран за пръв път като Cr2O3 · 2H2O, познат още под името виридиново зелено. Но как присъствието на зеления пигмент би могло да обясни покафеняването, наблюдавано при експериментите на изследователите? Учените предполагат, че редуцираният хром във виридиновото целено се е получил при окислението на масления компонент на боята. Тази окислена форма на маслото, заедно със зелено-жълтата смес, навярно стои в основата на оцветяването в кафяво.
Използвайки рентгенови техники, изследователите са могли да покажат, че смесената, по-светло оцветена боя съдържа серни компоненти. Те заключават, че тези компоненти по някакъв начин са свързани с редукцията на хрома и така обясняват защо в несмесените бои се наблюдава сравнително по-слабо потъмняване.
Рентгеновият лъч, насочен към ван Гог

Увеличи снимката
С любезното съдействие на
Van Gogh Museum, Amsterdam
След разгадаването на химическата реакция в отделните проби от бои, учените продължават да се питат дали потъмняването на повърхностния слой на пробите от жълто, взети от картините на ван Гог Гледка от Арл с ириси (1888) и Брегът на Сена (1887), се дължи на същото явление.
Рентгенова спектроскопия (XRF) била използвана за да се проследи химичния процес, протичащ на границата между тъмния повърхностен слой и намиращият се под него непроменен жълт слой боя. В определени точки от границата били събрани спектрални данни в близост до абсорбционния ръб на веществата (XANES). Откритията потвърдили резултатите от предишни експерименти: редуцирана форма на хрома Cr(III) била открита в по-тъмния повърхностен слой и се предположило, че тя е причина за кафявото оцветяване. Освен това Cr(III) не бил еднакво разпределен, а се появявал на места, където имало сулфат- и барий-съдържащи вещества
В химично отношение тези места наподобявали мострите от светло жълта боя от предишните експерименти, потвърждавайки заключенията на учените, че сяро-съдържащите вещества вземат участие в редукцията на хрома (виж уравнението по-долу). Заради белия им цвят ван Гог ги смесвал с хромното жълто за да направи по-светлите нюанси, които били съществени при създаването на ярко осветените сцени, характерни за този период от живота му.
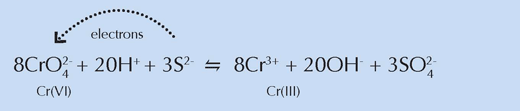
С любезното съдействие на Nicola Graf
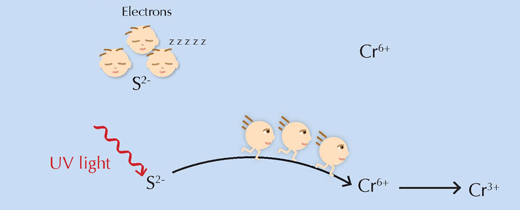
Останал още един важен въпрос: как всъщност работи предполагаемият тригер на реакцията, а имено UV- светлината? Просто дава на реактантите необходимата им енергия за да преодолеят енергийния праг, позволявайки на реакцията да протече (виж фиг.6 по-долу).
С любезното съдействие на Nicola Graf
Какво може да се направи?
Екипът на Янсенс разкри химията, която се крие зад потъмняването на картините на ван Гог. Но можем ли да използваме това познание за да спасим творбите на художника? Ела Хендрикс от Музея на ван Гогw3 в Амстердам, Холандия, изказва своите съмнения: ”Ултравиолетовата светлина… вече е намерен начин тя да бъде ограничена в съвременните музеи. Ние излагаме творбите в контролирана среда за да ги подържаме в най-доброто състояние.” Част от тази контролирана среда е подържането на ниска температура в музея. Като общо правило, повишаването на температурата с 10ºC, повишава фактора на реакциата от 2 на 4 и редукцията на хрома не прави изключение.
Така щом и UV нивото, и температурата се контролират, какво още може да се направи за картините на ван Гог? Съществува и по-радикална алтернатива: вместо да се забавя процеса на разграждане, да се направи опит той изцяло да бъде обърнат. „Следващите ни експерименти вече са в процес на подготовка,” казва Янсенс. „Очевидно искаме да разберем кои условия подпомагат редукцията на хрома и дали има надежда да върнем пигментите към изначалното им състояние в картините”w4
Въпреки, че да се върнат стрелките на часовника в случая е най-доброто решение, Янсенс признава, че перспективата на връщането на променените пигменти към първоначалния им цвят към момента е малко вероятна. Въпреки това, работата на учените ни дава увереност, че правим възможното за да запазим картините на ван Гог, както и надежда, че бъдещите поколения ще оценят постигнатото от този велик творец.
Изучаване на изкуство със синхротрон
Характеризирането на химичната страна на ценни творби на изкуството може да се окаже проблематично. Възможно е само да бъдат взети за анализ няколко много малки проби, а те често се състоят от разнородна смес сложни съединения в хетерогенно състояние. За да преодолеят тези предизвикателства, учените използват рентгенови техники. Колкото по-мощни и прецизни са рентгеновите лъчи, толкова по-добро е качеството на анализа. Най-ефикасните рентгенови лъчи са тези от синхротронен източникw2 (виж фиг.2 по-долу). В това изследване на ESRF върху пробите от боя са използвани две спектроскопски техники: XRF и XANES.
С любезното съдействие на EPSIM 3D / JF Santarelli, Synchrotron Soleil; източник: Wikimedia Commons
XANES
XANES спектроскопията се основава на принципа на рентгеновата абсорбция. Атоми на определен елемент абсорбират рентгеновите лъчи по характерен начин. Чрез сравняване на спектъра от рентгеновата абсорбция, представляващ зависимостта на рентгеновата абсорбция на даден елемент (по оста Х) от енергийното им ниво (по оста У), е възможно да бъдат установени кои са съдържащите се в пробата елементи. Рентгеновите спектри с висока резолюция обикновено се наблюдават в определени енергийни зони (наречени XANES), които се намират близо до границата на поглъщане на интересуващия ни елемент (виж фиг. 3 долу и 4). Подобни подробни спектри могат да покажат в каква степен на окисление е интересуващия ни елемент. Тази информация представлява огромен интерес за изследователите.
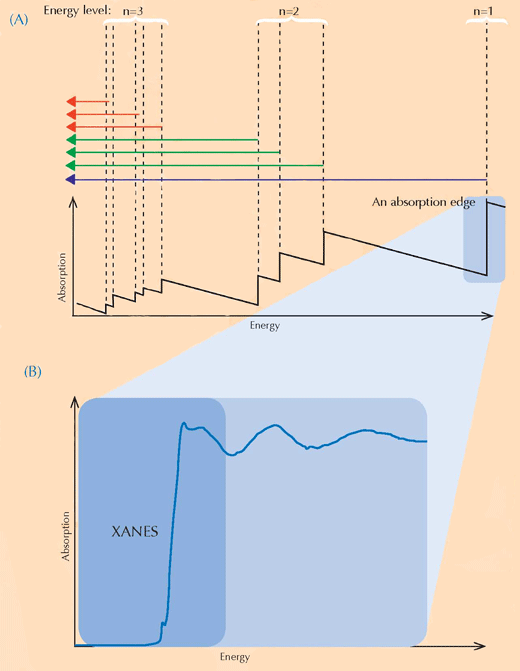
С любезното съдействие на Atenderhold; източник: Wikimedia Commons (B) Границата на поглъщане от близо. Ако погледнем отблизо видимо равна граница на поглъщане, ще установим, че се състои от множество по-малки колебания, отговарящи на по-малки поглъщания. Областта на водещата граница (оцветена в синьо), се нарича спектрални данни в близост до абсорбционния ръб на веществата (XANES, синьото каре) и съответства на електроните, придвижващи се към незаемани от тях енергийни нива, близки до онези, на които те са били. Областта на XANES се е използвала от учените, изследвали картините на ван Гог, тъй като тя може да даде информация за степента на окисление на атомите в пробата: атомите с различна степен на окисление, имат различен брой електрони (виж фиг.1, по-горе). Това променя стойтостта на техните енергийни нива, а оттам и спектъра на XANES.
С любезното съдействие на M Blank: източник; Wikimedia Commons
С любезното съдействие на Nicola Graf
XRF
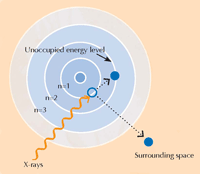
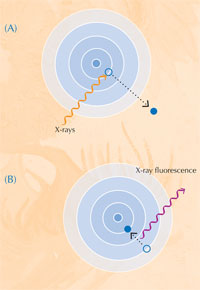
При поглъщане на рентгеновите лъчи, атомите преминават в нестабилно състояние. Когато след това се върнат в по-стабилно състояние, те излъчват вторични рентгенови лъчи, като този процес се нарича рентгенова флуоресценция (виж фиг. 5). Диаграмата на рентгеновата флуоресценция на дадена проба, наречен XRF спектър, може да се използва за откриване на разпределението на елементите на дадена площ. За разлика от него, спектрални данни в близост до абсорбционния ръб на веществата XANES могат за се използват само за малка област от пробата. При едновременното използване на информацията, получена от XRF и XANES, авторите са успели да получат детайлна картина на химичната същност на пробите от боя.
С любезното съдействие на Nicola Graf
Науката в изкуството
Какво мислите вие и вашите ученици? Необходимо ли е науката да се използва за спиране на процесите на разпадане на важни творби на изкуството или дори за връщането им към първоначалното им състояние? Или пък трябва следите на времето да бъдат приети и дори оценени като историческо доказателство?
References
- Monico L et al. (2011) Degradation process of lead chromate in paintings by Vincent van Gogh studied by means of synchrotron X-ray spectromicroscopy and related methods. 2. Original paint layer samples. Analytical Chemistry 83: 1224-1231. doi: 10.1021/ac1025122
Web References
- w1 – The European Synchrotron Radiation Facility (ESRF) е международен изследователски институт за изследване на фотоните. ESRF е член на EIROforum, издателя на Science in School. За да научите повече, посетете: www.esrf.eu
- w2 – За повече информация как синхротронното излъчване се използва в изследването, вижте:
- Capellas M, Cornuéjols D (2006) Shipwreck: science to the rescue! Science in School 1: 26-29.
- Capellas M (2007) Recovering Pompeii. Science in School 6: 14-19.
- w3 – За да научите повече за Винсент ван Гог и изкуството му, посетете чудесния сайт на музея на ван Гог: www.vangoghmuseum.nl
- Секция от сайта на музея съдържа и насоки за използване на образователните ресурси: www.vangoghmuseum.nl/vgm/index.jsp?page=110&lang=en
- w4 – За да чуете излъченото по BBC интервю с Коен Янсенс, който говори за своите изследвания върху картини на ван Гог, посетете: www.bbc.co.uk/programmes/b00yjs49
- w5 – CCLEAPSS е консултантска служба във Великобритания, осигуряваща подкрепа в преподаването на наука и технологии, по теми в здравеопазването и безопасността; оценка на опасността; източниците и използването на химикалите; както и живите организми и екипировката. За повече информация вижте: www.cleapss.org.uk
- За съвет за безопасност при използването на олово, хром и техните съединения, прегледайте предписанията за ученици, които можете да свалите безплатно от тук: http://www.cleapss.org.uk/free-publications/general-publications
Resources
- Изображения и симулация на изследването върху мостри от историческата боя могат да бъдат намерени на: www.vangogh.ua.ac.be
- За да научите повече за изкуството на консервацията, разгледайте:
- Leigh V (2009) The science of preserving art. Science in School 12: 70-75.
Institutions
Review
Настоящата статия свързва науката с изкуството и консервационните изследвания. Усъвършенстваните техники, използвани от учените, разкривата химичните промени в пигментите, проявяващи се десетилетия след като творбите на ван Гог са били завършени.
Настоящата статия е полезно средство да се демонстрира пред учениците факта, че винаги съществува научно обяснение на промяната на артефактите с времето. Най-практично е да се използва при работа с ученици на възранст 16-18 години. Статитята може да бъде използвата в часовете по химия, посветени на окислението и редукцията.
За да могат учениците да разберат химията, стояща зад изследването, бихте могли да им зададете следните въпроси:
- Работата на учените, описана в статията, показва, че сулфидните йони могат да бъдат химични агенти, причиняващи редукция на хрома. Напишете отделните химични уравнения за редукцията на оловния хромат (PbCrO4) от съдържащите сулфиден йон съединения H2S и PbS. Съвет: Съединенията на Cr(VI) са окисляващи агенти.
- Учените предполагат, че сулфат съдаржащите съединения в боите на ван Гог може би са източника на сулфидните йони. Опитайте се да се сетите за други начини, в следствие на които картините са изложени на сулфидните йони.
- Сребърните бижута потъмняват с времето, когато са в досег с въздуха. Напишете уравнението на реакцията, при коята това се случва. Вземете предвид, че това не е обикновена реакция на заместване.
За да покажете, че оловният хромат потъмнява под действието на сулфидните йони, можете да демонстрирате следния експеримент пред класа:
- Синтезирайте оловен хромат в колба като някоя водно-разтворима оловна сол като оловен(ІІ) ацетат Pb(CH3COO)2, или оловен(II) нитрат Pb(NO3)2, към равен обем разтвор на калиев хромат K2CrO4. Достатъчни са слаби разтвори (~ 0.03 M).
- Веднага ще се образува жълт преципитат от оловен хромат. Филтрирайте съдържащата го течност през фуния и филтърна хартия. Под камина внимателно изсушете преципитата като внимавате да не изсъхне напълно.
- Пригответе слаб воден разтвор на водороден сулфид (Na2S) като разтворите 50 mg натриев сулфид (Na2S) в 90 ml вода. Към така получената смес добавете 10 ml солна киселина (HCl, 0.1 M). Разбъркайте.
- Надуйте гумен балон и го свържете с малка стъклена бутилка на Дрехсел, съдържаща няколко милилитра слаб водородно сулфиден разтвор (виж изображението по-долу). Насочете струята от водород-сулфид-съдържащия газ въздух към оловно хроматния преципитат.
- Преципитатът веднага ще придобие кафяв цвят. Симулирали сте и сте ускорили процеса на потъмняване, наблюдаван при картините на ван Гог, няколко пъти.
Бележка за безопасност: Всички разтворими оловни соли са токсични, а разтворимите хроматни са токсични (над 0,003 М) и се предполага, че са канцерогенни. Калиевият хромат може да предизвика чувствителност и/или язви при контакт с кожата. Съществуват ограничени доказателства, че оловният хромат е канцерогенен. Той може да навреди на плода при бременните, така че не трябва да се използва ако учителят или някой от учениците са бременни. Водородният сулфид е токсичен газ с неприятна миризма.
Осъществете горе описания експеримент под камина и носете предпазни очила и ръкавици. Изхвърлете всички химикали според установените правила за безопасност. Прегледайте и общите правила за безопасност на Science in School. Може би ще ви бъде полезно да се консултирате с инструкциите за безопасност при работа с хром и олово на CLEAPSSw5.
Vladimir Petruševski, бивша Югославска република Македония






