Em busca de uma melhor bateria de iões de lítio Understand article
Tradução de Isabel Queiroz Macedo. A difracção de neutrões permite ver o que acontece aos eléctrodos numa bateria de iões de lítio.
As baterias de iões de lítio (iões-Li) alimentam os nossos telefones e computadores portáteis, e agora também alguns automóveis. No entanto, o lento progresso da tecnologia de baterias tem travado o desenvolvimento de automóveis eléctricos. Para ajudar a acelerar esse processo e a melhorar as baterias de iões-Li, os meus colegas e eu, no Institut Laue-Langevin (ILL) w1, construímos uma bateria muito grande para podermos ver melhor o que se passa no seu interior durante o funcionamento. Fizemos um filme que nos ajudou a ver como poderíamos melhorar os eléctrodos.
O poder do lítio
Sabemos que o lítio é um metal muito reactivo do grupo 1A da Tabela Periódica. Além de alimentar os nossos computadores, o lítio, um dos três elementos químicos criados no Big Bang, é também “combustível” nas estrelas.
E voltando à Terra, jazigos minerais e enormes lagos subterrâneos ricos em sais de lítio fornecem-nos anualmente cerca de 25 mil toneladas de lítio metálico. Uma grande parte é usada no fabrico de baterias de iões-Li, leves e recarregáveis.
As baterias de iões de lítio, tal como todas as outras, convertem energia química libertada em reacções redox espontâneas em energia eléctrica. Ao contrário de muitas outras baterias, as baterias de iões-Li são recarregáveis – aplica-se corrente eléctrica para provocar a reacção não espontânea. Quando a bateria está descarregada, ligamo-la à corrente eléctrica e assim ocorrem as reacções químicas inversas das que ocorreram enquanto ela estava em uso.
Como o nome indica, nas baterias de iões-Li a carga é transferida por iões lítio, carregados positivamente (Li+). Os materiais dos eléctrodos são compostos cristalinos: óxido de um ou mais metais de transição e lítio em um dos eléctrodos, e em geral grafite – que pode intercalar reversivelmente com lítio – no outro. Os eléctrodos estão mergulhados no electrólito, que permite que os transportadores de carga (iões lítio) se movam entre eles. As duas semi-reacções são, por exemplo, neste caso em processo de carga:
LiMn2O4 ⇌ Li1-xMn2O4 + xLi+ + xe–
xLi+ + xe– + xC6 ⇌ xLiC6
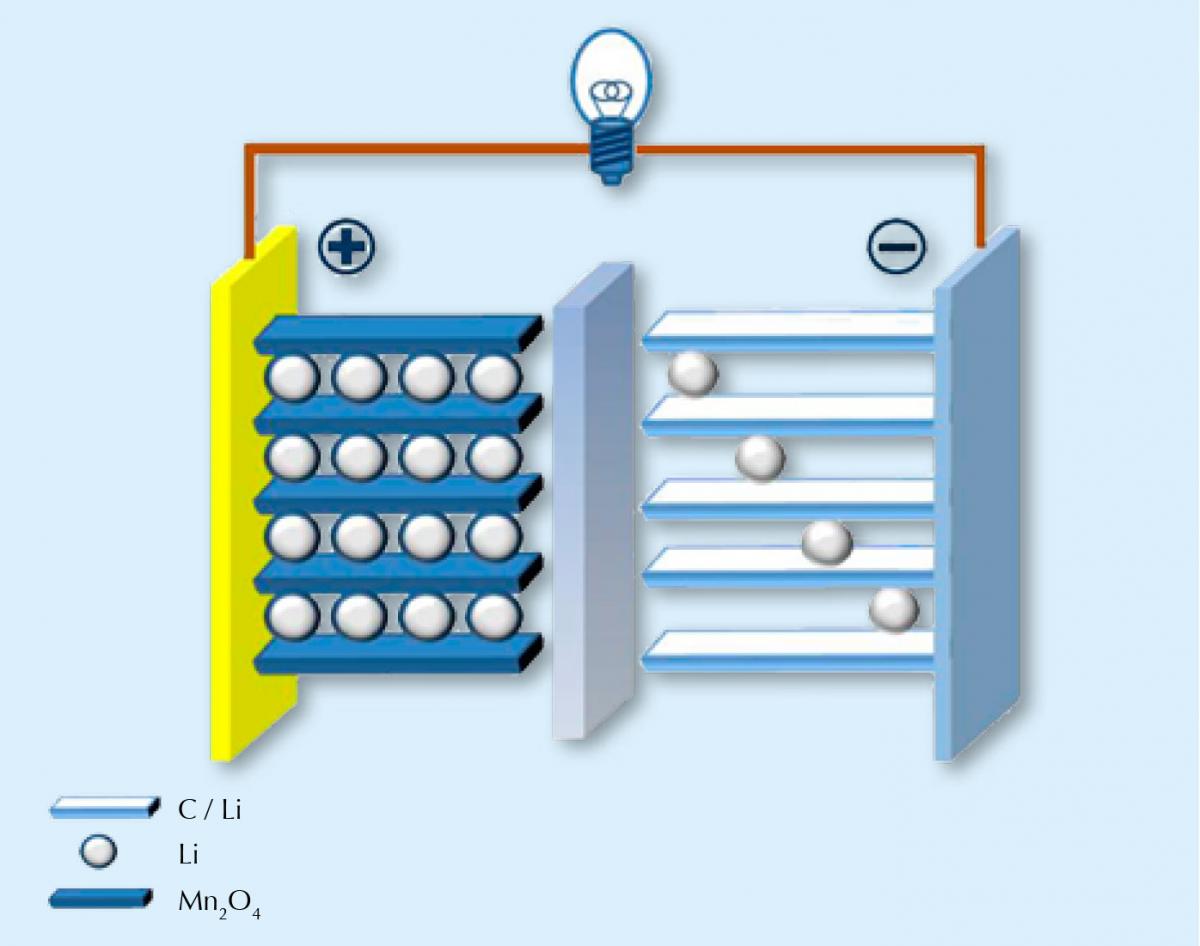
Imagem de domínio público Chem511grpThinLiBat; image source: Wikimedia Commons
Quando a bateria está a descarregar (quando está a fornecer energia), os iões lítio movem-se do eléctrodo de grafite para o eléctrodo de LiMn2O4 (reacções inversas às indicadas acima); durante o recarregamento da bateria, movem-se no sentido inverso. Infelizmente, o número de ciclos de carga-descarga não é ilimitado – com o tempo, a entrada e saída repetida de iões lítio altera a estrutura dos eléctrodos e diminui a sua eficiência. Podemos fazer a analogia com o desgaste das nossas roupas com o uso e as lavagens. As calças de ganga favoritas já não nos servem tão bem como quando eram novas e, do mesmo modo, os iões lítio não se encaixam tão bem na rede cristalina dos eléctrodos. A bateria perde capacidade.
Portanto, para melhorar as baterias é preciso melhorar os materiais dos eléctrodos – o que significa que precisamos de entender como esses materiais se comportam com ciclos repetidos de carga-descarga. É aqui que intervém o ILL e a sua fonte de neutrões, que nos permite ‘visualizar’ as alterações na estrutura cristalina dos eléctrodos. A difracção de neutrões é uma excelente técnica para ver como os iões lítio se movem através dos eléctrodos, porque os neutrões são facilmente difractados por elementos leves como o lítio.
Filmes em tempo real
eléctrodo sofrem diferentes
alterações com os ciclos de
carga-descarga
Imagem cortesia do autor
Para investigar o que acontece nos materiais de eléctrodo durante o funcionamento, desenvolvemos uma bateria especial (Bianchini M et al 2013; 2014). O objectivo foi obter um filme de elevada qualidade de todo o processo. Para fazer o filme, criámos muitas imagens de difracção de neutrões dispersando-os pelo material do eléctrodo enquanto a bateria era carregada e descarregada. Em seguida usámos essas imagens para o filme, como num filme de animação em stop-motion; passando as imagens em sequência simulamos movimento e podemos ver o que realmente aconteceu no eléctrodo.
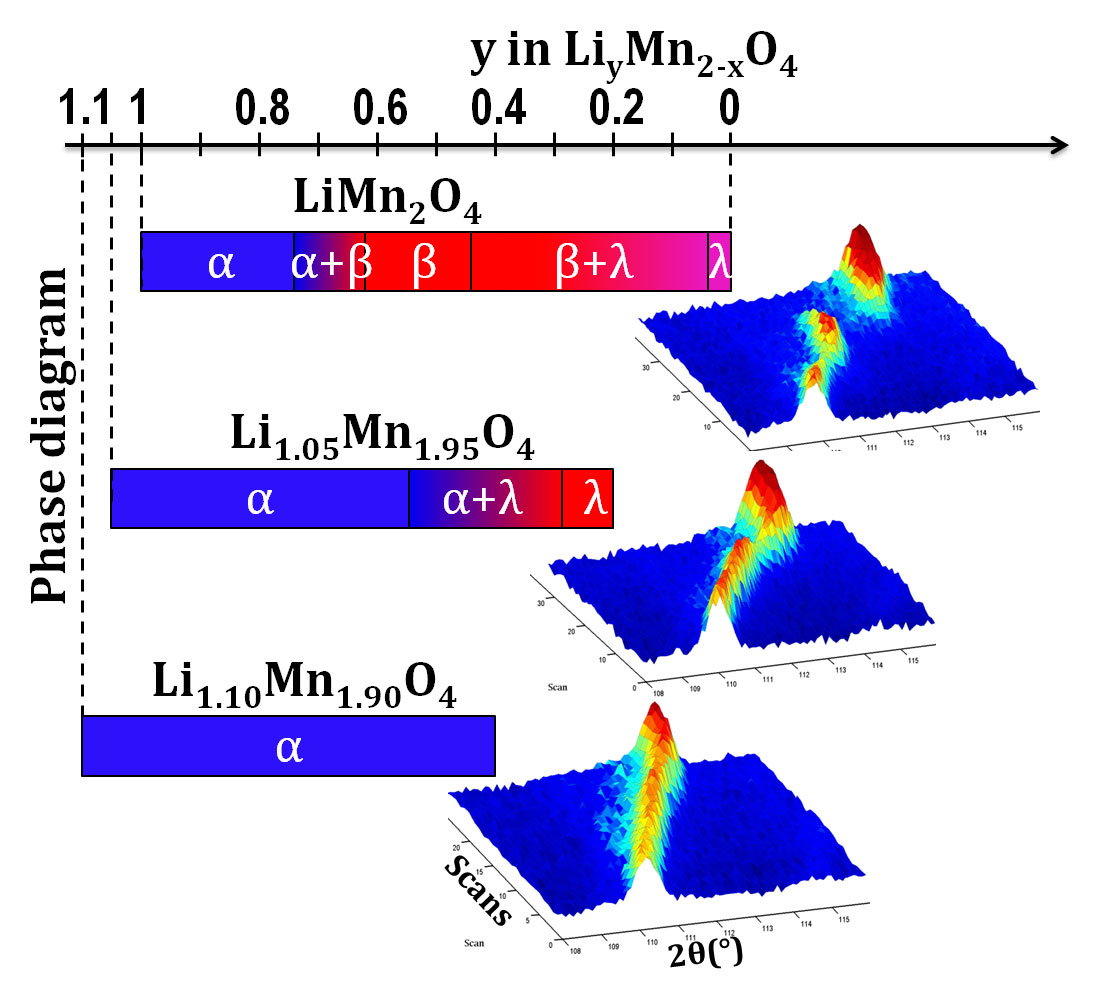
Primeiro, testámos e optimizámos o funcionamento de uma única célula, a metodologia e a qualidade dos padrões de difracção. Usámos para isso materiais de eléctrodo relativamente bem compreendidos, como o fosfato de ferro e lítio (LiFePO4), que é usado para fabricar eléctrodos seguros, baratos e de longa duração. Uma vez satisfeitos com essas experiências, estudámos o comportamento de novos materiais de eléctrodo baseados em óxido de manganês e lítio (LiMn2O4). O LiMn2O4 é um material interessante, já que proporciona elevada capacidade e elevada velocidade de carga-descarga, embora a capacidade diminua rapidamente com os ciclos de carga-descarga, o que impede a sua aplicação comercial. Modificámos ligeiramente a fórmula molecular e descobrimos que se aumentarmos a percentagem de lítio e diminuirmos a de manganês podemos melhorar esse aspecto.
Assim, com base na fórmula molecular LiMn2O4, sintetizámos três compostos com a fórmula Li1+xMn2-xO4, onde x é a quantidade adicional de lítio. Os três compostos tinham valores de x de 0, 0.05 e 0.10. Observando a estrutura cristalina e o comportamento dos três eléctrodos em ciclos de carga-descarga, verificámos que o lítio adicional reduz a capacidade útil da bateria, mas melhora a autonomia – a bateria não tem muita carga, mas descarrega mais lentamente.
E pudémos adiantar algumas causas:
- À medida que a quantidade de lítio no material do eléctrodo aumenta, a variação de volume devida à perda de iões lítio diminui, e o mecanismo físico envolvido sofre uma alteração.
- Quando aumentamos a quantidade de lítio, diminuímos a quantidade de Mn3+ de um valor equivalente, e sabemos que este ião diminui a vida útil das baterias.
Concluímos que o material de eléctrodo mais rico em lítio é muito melhor.
Mostrámos que a difracção de neutrões pode ajudar-nos a entender o comportamento dos iões lítio e das baterias de iões-Li, e encontrámos uma maneira de melhorar essas baterias. Como os resultados foram promissores, alargámos o estudo a composições diferentes, com níquel adicional (LiMn1.6Ni0.4O4), que permitem operar com voltagens mais elevadas e, portanto, com mais energia. Talvez um dia o nosso trabalho contribua para a termos carros eléctricos mais rápidos e duradouros.
A bateria transparente
A bateria especial que usámos nesta experiência tem eléctrodos maiores do que o normal, que nos permitiram obter padrões de difracção de neutrões de melhor qualidade. A característica mais importante desta bateria é a que resulta de termos utilizado uma liga de titânio-zircónio, que é transparente a neutrões, ou seja, não provoca dispersão de neutrões; eles atravessam o material sem sofrer perturbação. Deste modo, o sinal detectado provém apenas do eléctrodo de interesse – não há contribuições indesejadas. Também utilizámos electrólito deuterado, substituindo átomos de hidrogénio por átomos de deutério, mais pesados, para reduzir ainda mais a dispersão e melhorar o sinal obtido.
Apesar de a bateria ser maior do que o normal, as amostras que analisámos ainda eram pequenas (≈200 mg) em comparação com as quantidades normalmente requeridas para experiências de difracção de neutrões (≈1 g). Mas, graças ao elevado poder da fonte de neutrões do ILL e aos difractómetros de última geração de que dispúnhamos, obtivemos as imagens desejadas.

Imagem de Wurzeller [domínio público]; fonte:Wikimedia Commons
Mais sobre o ILL
O Institut Laue-Langevin (ILL)w1 é um centro de investigação internacional com sede em Grenoble, França. Este instituto é líder mundial em ciência e tecnologia de difracção de neutrões há mais de 45 anos, desde que as experências começaram, em 1972. O ILL tem uma das fontes de neutrões mais potentes do mundo; dispara feixes de neutrões para um conjunto de 40 instrumentos de alto desempenho, que são constantemente melhorados. Por ano, 1200 investigadores de mais de 40 países visitam o ILL para realizar experiências de investigação nas áreas de física da matéria condensada, química, biologia, física nuclear e ciência de materiais.
O ILL é membro do EIROforumw2, o organismo que publica a Science in School
References
- Bianchini M et al (2013) A New Null Matrix Electrochemical Cell for Rietveld Refinements of In-Situ or Operando Neutron Powder Diffraction Data. Journal of the Electrochemical Society 160: A2176–A2183. doi: 10.1149/2.076311jes
- Bianchini M et al (2014) Li-Rich Li1+xMn2–xO4 Spinel Electrode Materials: An Operando Neutron Diffraction Study during Li+ Extraction/Insertion. Journal of Physical Chemistry C 118: 25947–25955. doi: 10.1021/jp509027g
Web References
- w1 – Se quiser saber mais sobre o ILL.
- Consulte a lista dos artigos relacionados com o ILL publicados na Science in School.
- w2 – O EIROforum é uma entidade que junta oito das melhores organizações internacionais europeias de investigação científica, que combinam os seus recursos humanos e de infra-estruturas e o seu conhecimento e experiência para ajudar a ciência europeia a alcançar o seu pleno potencial. Uma das actividades de educação e divulgação do EIROforum é a publicação da Science in School.
Resources
- O European Synchrotron Radiation Facility (ESRF, Laboratório Europeu de Radiação de Sincrotrão) em Grenoble, França, também já acolheu cientistas que estudam baterias de iões de lítio; há um artigo interessante sobre o assunto em: na edição de julho de 2015 das ESRF news, pág 16-17
Institutions
Review
As baterias de iões de lítio são uma das aplicações da electroquímica mais presentes no quotidiano dos estudantes. No entanto, a sua baixa capacidade e durabilidade são factores que estão a atrasar a sua implementação, por exemplo, em veículos eléctricos.
Neste artigo, cientistas do Instituto Laue-Langevin (ILL) explicam o trabalho que levaram a cabo para melhorar as características das baterias de iões-Li. Os professores podem usar o artigo para dar exemplos de investigação de ponta e para explicar os conceitos básicos de electroquímica em que se baseia o funcionamento das baterias.
Pode-se conversar sobre vários assuntos que vêm a propósito, como a direcção da corrente eléctrica, o fluxo de electrões, a função do electrólito, ou a estequiometria dos compostos iónicos. O artigo pode também ser usado para falar sobre as dificuldades que surgem durante o desenvolvimento de um produto tecnológico, usando o exemplo da durabilidade e da capacidade das baterias. Permite, além disso, fazer a ligação entre ciência dos materiais e electroquímica. E é um bom ponto de partida para falar sobre questões ambientais, em particular do destino das baterias e da poluição electrónica, e-waste.
Duarte Nuno Januário, Portugal





