Química colorida: reacções redox com chupa-chupas Teach article
Com um chupa-chupa podemos ilustrar reacções redox com várias mudanças de cor espectaculares.
As reacções de oxidação-redução (redox) fazem parte dos programas de química do ensino secundário. Neste artigo descrevemos uma experiência com várias mudanças de cor para ilustrar uma cadeia de reacções redox, de transferência de electrões entre um açúcar e diferentes iões. A actividade pode ser executada pelo professor ou pelos alunos.

IanRedding/Shutterstock.com
Agentes oxidantes e redutores
Uma reacção redox é uma reacção química em que há transferência de um ou mais electrões de um reagente para outro. O agente redutor perde electrões, e é oxidado, e o agente oxidante aceita os electrões, e é reduzido. Nesta experiência o agente redutor é a glucose de um chupa-chupa. Quando se adiciona glucose a uma solução de um oxidante em meio alcalino, o grupo aldeído da glucose cede electrões e converte-se em grupo carboxílico (na forma de carboxilato devido ao meio alcalino):
–CHO + 3 OH– → –COO– + 2 H2O + 2 e–
(grupo aldeído) (grupo carboxílico, na forma de carboxilato)
Em certas condições experimentais, os grupos álcool da glucose também cedem electrões, dando origem a grupos carboxílicos (no caso de álcoois primários) ou a grupos cetona (no caso de álcoois secundários):
–C(H)(OH)– + 2OH– → –C(=O)– + 2H2O + 2e–
(grupo álcool secundário) (grupo cetona)
Nesta experiência adiciona-se glucose a uma solução aquosa de permanganato de potássio em meio alcalino (com hidróxido de sódio, NaOH). No início há transferência de electrões da glucose para o ião permanganato. A glucose, C6H12O6 (CH2OH (CHOH)4COH), é assim oxidada. O principal produto de oxidação é ácido glucónico, C6H12O7 (CH2OH (CHOH)4COOH), na forma de glucoconato (CH2OH (CHOH)4COO-) devido ao meio alcalino. Se o chupa-chupa tiver frutose, um isómero da glucose, a frutose é convertida numa mistura de aldoses (glucose e manose) em meio alcalino, e assim o principal produto da reacção é também ácido glucónico na forma de gluconato.
Numa série de reacções redox, há transferência de electrões de glucose para sucessivos compostos de manganês (Mn). Em cada passo forma-se um composto de Mn de cor diferente. O manganês é o elemento ideal para esta experiência porque é o metal de transição com mais estados de oxidação (de +2 a +7), em compostos de cor sempre diferente.
Esta experiência é uma adaptação do ”camaleão químico” w1, actividade que os alunos provavelmente já conhecem. Na versão original adiciona-se uma solução de glucose a uma de permanganato, agita-se com uma espátula e aparecem várias cores. Se se substituir a solução de glucose por um chupa-chupa, a dissolução da glucose na solução é mais lenta, o que facilita a visualização das mudanças de cor. Se usarmos um agitador eléctrico, a dissolução do açúcar do chupa-chupa é mais rápida do que com agitação manual.
Material
O material necessário é o seguinte (ver figura 1):
- Cristais de permanganato de potássio (KMnO4)
- Chupa-chupa esférico contendo glucose, frutose ou sacarose
- 3-4 pellets de hidróxido de sódio (NaOH) (cerca de 0.5 g)
- 200 mL de água destilada
- Copo ou erlenmeyer de 250 mL (de plástico ou de vidro)
- Colher e espátula
- Mini agitador eléctrico, por exemplo, batedor de leite
- Fita adesiva

Marisa Prolongo
Nota de segurança:
Os alunos devem usar bata, luvas e óculos de segurança. Os professores devem cumprir as regras de segurança adoptadas na escola, em particular no que diz respeito à utilização de permanganato de potássio e ao destino da solução final. Ver também a normas de segurança.
Procedimento
A actividade é adequada a uma aula de 50 minutos. A experiência demora cerca de 15 minutos e pode ser seguida de discussão de uma série de questões.
Os passos são os seguintes:
- Coloque 200 mL de água destilada no copo ou no erlenmeyer.
- Adicione os pellets de NaOH e agite com a colher até dissolução completa.
- Adicione com a espátula alguns (muito poucos) cristais de permanganto de potássio (KMnO4). Adicione a pouco e pouco e páre quando a cor for intensa mas não escura. O KMnO4 dissolve-se, e na solução ficam iões potássio, K+, e iões permanganato, MnO4–.
- Desembrulhe o chupa-chupa e fixe o pau no agitador eléctrico com fita adesiva (figura 1).
- Insira o chupa-chupa na solução e ligue o agitador.
À medida que o chupa-chupa se dissolve na solução e ocorrem as reacções redox, podemos observar as mudanças de cor. As duas primeiras mudanças são muito rápidas (3-5 segundos), enquanto as seguintes demoram um pouco mais. Os alunos podem tirar fotografias para seguir as mudanças de cor. Os autores disponibilizaram a demonstração da experiência em video w2, em espanhol.
Que acontece na experiência?
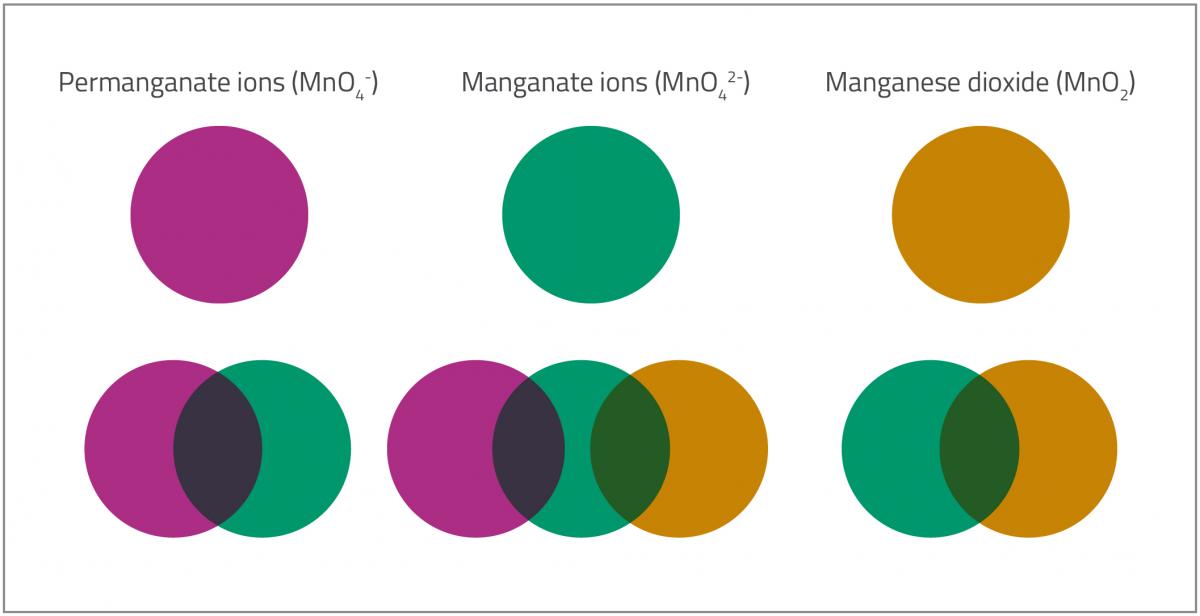
Quando dissolvemos o chupa-chupa na solução de permanganato, vemos cinco cores (figura 2), de 4 compostos de manganês em que este átomo tem estados de oxidação diferentes.
- A primeira cor (violeta) é devida aos iões permanganato (MnO4–). O manganês tem estado de oxidação +7.
- Os iões permanganato, MnO4–, são reduzidos a iões manganato, MnO42–. O estado de oxidação do manganês passa de +7 a +6 e a cor da solução muda de violeta para verde.MnO4–(aq) (violeta) + e– → MnO42–(aq) (verde)Há uma cor intermédia, azul, entre as fases 1 e 2. Uma explicação é que as duas cores, violeta do permanganato (MnO4–) e verde do manganato (MnO42–), se combinam e dão cor azul à mistura. Outra explicação é que parte do permanganato é reduzido a hipomanganato (MnO43–), azul. Neste ião, Mn tem estado de oxidação +5.
MnO4– (aq) (violeta) + 2e– → MnO43–(aq) (azul)
- Os iões manganato, MnO42–, são reduzidos a dióxido de manganês, MnO2, um composto castanho amarelado pouco solúvel. O estado de oxidação de Mn passa de +6 (em MnO42–) a +4 (em MnO2).MnO42–(aq) (verde) + 2 H2O(l) + 2e– → MnO2(s) + 4OH–(aq) (amarelo acastanhado)
- Finalmente, quando se incorpora mais glucose, a concentração de dióxido de manganês, MnO2, aumenta. O dióxido de manganês é um sólido castanho, mas em partículas muito pequenas dispersas na água confere-lhe uma tonalidade amarela e, se mais concentrado, cor-de-laranja.

Marisa Prolongo
Variações nas mudanças de cor
Os corantes artificiais do chupa-chupa não têm grande influência nas cores que observamos nesta experiência, mas há alguns factores que são importantes. Uma vez iniciada a reacção, há mistura de iões corados (de compostos de manganês) que resulta em misturas de cores que nem sempre são fáceis de interpretar (figura 3).
Como já se disse atrás, a velocidade destas reacções depende da concentração de glucose na solução, e consequentemente da velocidade de agitação (que serve para facilitar a dissolução da glucose do chupa-chupa). A velocidade destas reacções também depende da concentração de composto de manganês, logo, da quantidade de permanganato que se adiciona, e do pH, logo, da quantidade de NaOH. Assim, todos estes parâmetros influenciam a velocidade a que ocorrem as mudanças de cor.
Nicola Graf
Permanganate ions (MnO4–): Iões permanganato (MnO4–), Manganate ions (MnO42-): Iões manganato (MnO42-), Manganese dioxide (MnO2): Dióxido de manganês (MnO2)
Configuração electrónica de metais de transição
Os electrões movimentam-se em torno do núcleo em regiões denominadas orbitais. As orbitais distribuem-se em camadas e subcamadas e cada subcamada tem uma determinada energia associada. Por exemplo, no manganês, as orbitais 3s, 3p e 3d estão numa camada, que tem 3 subcamadas, 3s, 3p e 3d. A subcamada 3d tem 5 orbitais, que podem acomodar até 10 electrões. Os metais de transição podem perder vários electrões da subcamada externa, de orbitais d, e assim têm vários estados de oxidação.
Quando os electrões absorvem radiação eletromagnética de certas frequências, passam para um estado de energia mais elevado. Em muitos compostos de metais de transição, a diferença de energia entre as orbitais d corresponde à energia de radiação do espectro de luz visível e a cor é devida a transições de electrões entre orbitais d. Mas nem sempre é assim. Por exemplo, no ião permanganato o Mn tem estado de oxidação +7: Mn [Ar] 4s2 3d5; Mn7+ [Ar] 4s0 3d0. As orbitais d estão vazias e neste caso a cor é devida a transferência de electrões de orbitais dos ligandos (oxigénio) para orbitais d vazias do metal. Esta diferença de energia corresponde ao comprimento de onda da zona amarela do espectro electromagnético. Assim, os electrões absorvem a cor amarela, e o que vemos é a cor complementar do amarelo, ou seja, violeta. Vemos a cor da radiação que não foi absorvida (figura 4).
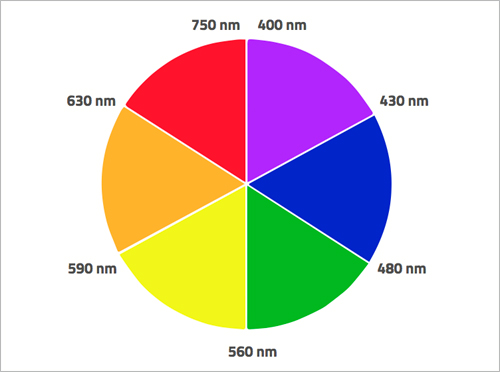
Nicola Graf
Discussão
Para relacionar a experiência do chupa-chupa com a química de reações redox, discuta as seguintes questões com os alunos:
- Na experiência, qual é o agente redutor, ou seja, a espécie química que dá electrões nas reacções redox?
Isso depende de qual é o açúcar que usamos; neste caso o agente redutor é a glucose, C6H12O6 (CH2OH (CHOH)4 COH). - Qual é o agente oxidante, a espécie química que aceita electrões?
O primeiro agente oxidante é o ião permanganato e o segundo é o ião manganato. - O ião manganato em solução aquosa absorve a parte da luz visível que corresponde à cor que vemos (verde) ou à cor complementar do verde (vermelho)?
O ião manganato absorve a radiação eletromagnética da zona vermelha do espectro visível, e o que vemos é a cor complementar do vermelho, verde. - Conhece outro elemento químico que apresente cores diferentes em diferentes estados de oxidação em solução?
Por exemplo: crómio (Cr2O72–, cor-de-laranja; CrO42–, amarelo) e vanádio (V2+, violeta; V3+, verde; VO2+, azul; VO43–, amarelo) - Quais são as principais aplicações do manganês em biologia e na indústria?
Utilizam-se compostos de manganês, por exemplo, em aços inoxidáveis, em baterias, em pigmentos ou como aditivos de combustível. O manganês é também um cofactor de muitas enzimas, como o fotossistema II, em cloroplastos. No entanto, em grandes quantidades é tóxico para os seres humanos.
Variações desta experiência
Esta experiência pode ser realizada de várias maneiras. Podemos, por exemplo, substituir o chupa-chupa por pastilha elástica que contenha açúcar, ou o copo por uma garrafa de plástico, que depois agitamos para observar as mudanças de cor (figura 5). Os alunos podem dar largas à criatividade e propor experiências alternativas.

Marisa Prolongo
Agradecimentos
Este artigo é baseado numa apresentação no Festival Espanhol de Ciência (Ciencia en Acción) em 2014. O trabalho foi inicialmente realizado por alunos da Escola Secundária IES Manuel Romero, em Málaga, Espanha. Agradecemos o apoio dado pela Universidade Técnica de Madrid (Universidad Politécnica de Madrid) aos projectos “Promoção da aprendizagem experimental da química” e “Chem-Innova”, e o apoio da Sociedade Real Espanhola de Química (Real Sociedad Española de Química, RSEQ).
Web References
- w1 – Para variações desta experiência, visite o Science Brothers website e o Hobby Chemistry website.
- w2 – Pode ver um vídeo desta experiência em espanhol no YouTube e no IES Manuel Romero Secondary School website.
Resources
- Para ideias sobre a introdução a reacções redox usando exemplos do dia-a-dia, consulte:
- Voak H (2016) Reacções redox: recursos. Science in School 36.
- Para uma experiência de mudança de cor com corantes vegetais sensíveis ao pH, consulte:
- Shimamoto GG, Vitorino Rossi A (2005) Uma introdução artística às tintas à base de antocianinas. Science in School 31.
Institutions
Science on StageReview
A química redox do manganês é um aspecto fascinante da química dos metais de transição. Este exercício simples e prático familiariza os alunos com os vários estados de oxidação do manganês e a cor dos respectivos compostos.
A observação das mudanças de cor suscita a discussão e é um ponto de partida para a compreensão do que se passa em reacções de oxidação-redução, e nestas em particular.
Andrew Galea, professor de química na Escola secundária Giovanni Curmi, Malta





