Investigando a acção da urease Teach article
Traduzido por Artur Melo. Anna Lorenc do projecto Volvox explica a importância da enzima urease e apresenta um protocolo para demonstrar a actividade da urease, em sala de aula.
As enzimas desempenham um papel essencial no metabolismo de todos os organismos. Catalisam e controlam a maior parte das reacções químicas no nosso corpo – desde a replicação da informação genética (DNA polimerase) à digestão. A actividade enzimática nem sempre é, no entanto, fácil de visualizar. Este é um protocolo simples e barato para auxiliar o ensino do tema ‘actividade enzimática’, em sala de aula. Todos os materiais necessários são fáceis de obter e seguros.
Nesta investigação, a enzima urease dos feijões de soja (Glycine max) desdobra a ureia em amónia e dióxido de carbono:
CO(NH2)2 + H2O → 2 NH3 + CO2
A solução de amónia (NH3) tem um pH elevado que pode ser determinado com um indicador de pH vulgar, tal como o que se pode extrair da couve-roxa. A amónia produzida na reacção pode também ser detectada pelo seu odor.
Como a urease é produzida por uma larga variedade de organismos, esta actividade prática pode ser utilizada em aulas sobre:
- Ciclo do azoto
- Influência dos organismos no seu meio ambiente
- Adaptação dos animais a diversas dietas.
Base teórica do protocolo
O que é a ureia?
Todos os organismos decompõem ácidos nucleicos e proteínas produzindo resíduos azotados, pois os ácidos nucleicos e as proteínas contêm azoto. Os mamíferos, anfíbios e alguns invertebrados libertam resíduos azotados na forma de ureia, que é produzida no fígado. A ureia é um composto especialmente indicado para a eliminação de azoto, pois é solúvel em água e menos tóxica que a amónia – que é o produto da excreção nos peixes, por exemplo. A urina humana contém 2% de ureia.
A ureia foi, também, o primeiro composto orgânico a ser sintetizado. Em 1828, Friedrich Wöhler sintetizou ureia a partir de compostos inorgânicos (cianato de chumbo e hidróxido de amónia). Foi um acontecimento de referência: até então acreditava-se que apenas os seres vivos eram capazes de produzir compostos orgânicos, e achava-se que estes compostos eram especiais, sendo necessária uma ‘força vital’ para os sintetizar. Wöhler estabeleceu a ligação entre o mundo dos seres vivos e o dos seres não vivos. Não recebeu, no entanto, um Prémio Nobel pela sua descoberta, porque esse prémio ainda não existia. Hoje, a ureia é sintetizada em enormes quantidades: é usada no fabrico de plásticos e como fertilizante azotado barato.
O que é a urease?
A urease catalisa a hidrólise de ureia em dióxido de carbono e amónia. Encontra-se principalmente em sementes, microrganismos e invertebrados. Nas plantas, a urease é um hexâmero – consiste em seis cadeias idênticas – e localiza-se no citoplasma. Em bactérias, é constituída por duas ou três subunidades diferentes. Para ser activada, a urease precisa ligar-se a dois iões níquel por subunidade.
Como se tornou a urease famosa?
A urease de feijões-sabre (Canavalia ensiformis) foi a primeira enzima a ser purificada e cristalizada, um feito de James B. Sumner em 1926, numa altura em que a maior parte dos cientistas acreditava ser impossível cristalizar enzimas. Este feito valeu-lhe, em 1946, o Prémio Nobel da Química. Actualmente, a cristalização de proteínas ajuda os cientistas a determinar a sua estrutura e a saber como funcionam. Este conhecimento permite a criação de substâncias que interferem com a acção enzimática, tais como medicamentos anti-SIDA que inibem a acção das enzimas do HIV ou os desenvolvimentos recentes com vista a um possível tratamento para a raiva (Ainsworth, 2008).
Porque existe urease nos feijões de soja?

Imagem cortesia de iStockphoto
O papel da urease nos feijões de soja não é completamente claro, apesar de podermos especular. As folhas de soja também contêm urease, mas nelas a enzima é mil vezes menos activa que nos feijões. Sabe-se que a enzima das folhas ajuda a reciclar o azoto presente nas proteínas (as proteínas são transformadas em ureia). Nos feijões, a urease faz o mesmo durante a germinação. A amónia que resulta da reacção pode também proteger as células da planta de agentes patogénicos – parece que a própria enzima da planta é um insecticida.
Onde mais podemos encontrar a urease?
Muitas espécies de bactérias produzem urease, incluindo Helicobacter pylori, a bactéria responsável pelas úlceras do estômago. Ao fazer isto, H. pylori eleva o pH do suco gástrico de aprox. pH 3 para pH 7, o pH óptimo para se desenvolverem. Um teste para H. pylori disponível no mercado verifica a presença de urease no ar expirado, sendo usado como diagnóstico de úlceras estomacais.
Os ruminantes (tal como vacas e ovelhas) possuem bactérias que digerem celulose na sua pança – o primeiro compartimento do estômago – para os ajudar a digerir a dieta vegetal. Os ruminantes libertam ureia nesta região do estômago, constituindo a ureia uma excelente fonte de azoto para o crescimento de bactérias. Para captar o azoto, as bactérias segregam urease para decompor a ureia. Eventualmente, os animais digerem a massa de bactérias.
Será a urease da soja prejudicial para os seres humanos?
A urease não é perigosa. No entanto, o feijão de soja cru contém outros compostos que não são saudáveis. Por exemplo, existe um inibidor proteico no feijão de soja cru que impede a enzima digestiva tripsina de tornar os feijões de soja comestíveis. A presença do inibidor não é fácil de detectar, mas felizmente possui um nível semelhante de intolerância ao calor que a urease – ambos são inactivados pelo calor. Por isso, para assegurar que o inibidor é desactivado, produtos de feijão de soja (farinha de soja ou alimentos que contêm soja, tais como ‘tempe’ e ‘tofu’) são testados relativamente à actividade da urease – de forma semelhante ao teste aqui descrito. Se não for detectada qualquer actividade da urease, o inibidor também foi presumivelmente desactivado.
Urease no ciclo do azoto
O azoto é um elemento crucial para o crescimento das plantas, mas a maior parte delas apenas consegue usá-lo na forma de amónio ou nitrato. Apenas as leguminosas (graças às bactérias com as quais vivem em simbiose) e as cianobactérias conseguem usar azoto elementar atmosférico.
Muitos animais libertam ureia através da urina. Os microrganismos do solo alimentam-se da urina animal, produzindo urease para transformar a ureia em amónia, que fica assim acessível para as plantas. Esta é uma parte do ciclo do azoto, o processo pelo qual o azoto das proteínas e outros compostos é constantemente reciclado.
O protocolo
Este protocolo permite aos alunos detectar a actividade de uma enzima vegetal das sementes. Quando o substrato (ureia) está presente, a urease desdobra-o em dióxido de carbono e amónia. Dissolvida em água, a amónia eleva o pH, um efeito observável com o indicador de pH da couve-roxa. Na experiência, os alunos verificam que para obter o produto (amónia), são necessários tanto o substrato (ureia) como a enzima (urease). Observam que a actividade da enzima aumenta o pH.
Extracto de couve-roxa – um óptimo indicador de pH
Neste protocolo, usamos extracto de couve-roxa como indicador de pH. Ele contém antocianinas. A estrutura e a cor (em solução) destes compostos são sensíveis ao pH. A pH 7, a solução é violeta/azul; no intervalo ácido de pH fica vermelho. Quando o pH é superior a 7, e a solução é mais alcalina, o extracto fica verde. Estas alterações de cor são reversíveis – basta ver o que acontece quando juntamos ácido cítrico e em seguida soda (bicarbonato de sódio).
Materiais e equipamento
Para cada aluno ou grupo de alunos:
- 20 ml de solução 10% de ureia fertilizante (um fertilizante sólido constituído por ureia pura)
- 5 ml de solução 10% de ácido cítrico (ou outra solução de pH baixo)
- 5 ml de solução 10% de bicarbonato de sódio (NaHCO3) (ou outra solução de pH elevado)
- 40 ml de indicador de couve-roxa, preparado como se descreve a seguir
- 10 ml de extracto de feijão de soja, preparado como se descreve a seguir (a partir de 1 g de feijão de soja seco)
- 10 ml de água destilada
- pipetas de Pasteur ou palhinhas de plástico, para transferir as soluções
- 6 tubos de ensaio e um suporte para tubos.
Para preparar o extracto de soja e o indicador de couve-roxa, é necessário um misturador e água a ferver, assim como filtro de café e um funil.
Tempo de preparação
A experiência pode ser concluída em 30 minutos.
A suspensão de feijões de soja e o extracto de couve-roxa podem ser feitos antecipadamente, ou a sua preparação pode ser demonstrada durante a aula. Demora apenas dez minutos, mas tenha em atenção que os feijões de soja devem ser embebidos em água durante pelo menos uma hora antes da aula.
A reacção entre a urease da soja e a ureia também demora cerca de dez minutos.
Preparação
Indicador de couve-roxa
- Cortar duas folhas grandes de couve-roxa em tiras e colocá-las num recipiente resistente ao calor, p. ex. um gobelé. Despejar 200 ml de água a ferver, mergulhando completamente as folhas.
- Após 5 minutos, decantar o liquido e deixar arrefecer.
- Colocar as folhas de lado.
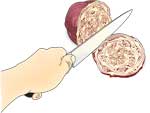
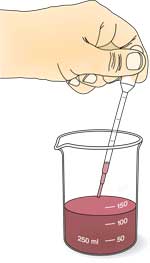

Extracto de feijão de soja com urease
- Mergulhar os feijões de soja em água durante pelo menos 1 h (de preferência durante a noite).
- Misturar os feijões de soja embebidos num misturador, com cerca de 10 ml de água por grama de soja seca (a água de embeber os feijões pode ser usada) até a mistura estar cremosa (durante cerca de 5 minutos).
- Filtrar o puré de soja através de um papel de filtro num funil.
- Recolher e guardar o filtrado, que contém urease.

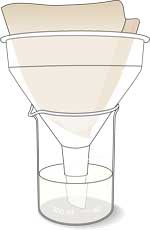

Investigação
Os volumes indicados a seguir são para tubos de ensaio de vidro standard (~10 ml).
Primeiro pedir aos alunos que verifiquem como o pH influencia a cor do extracto de couve-roxa.
- Colocar 3 ml de indicador de couve-roxa em cada um de três tubos.
- Juntar 2 gotas de solução de ácido cítrico ao primeiro tubo de ensaio. Agitar e observar a alteração da cor. Enxaguar a pipeta com água após a adição de cada componente.
- Juntar 2 gotas de solução de bicarbonato de sódio ao segundo tubo de ensaio. Agitar e observar a alteração da cor.
- Juntar 2 gotas de água destilada ao terceiro tubo de ensaio. Agitar e observar a alteração da cor.
- Comparar e registar as cores das soluções nos três tubos de ensaio. Guardar os tubos para servirem como referência (controlo).
Em seguida, investigue o efeito da urease do feijão de soja sobre a ureia.
- Colocar 2 ml de indicador de couve-roxa em cada um de três tubos de ensaio.
- Adicionar 2 ml de solução de ureia a cada um de dois tubos de ensaio. Registar a cor.
- Adicionar 2 ml de suspensão de soja ao terceiro tubo e a um dos tubos com solução de ureia.
- Comparar as cores e os odores das misturas em todos os tubos. Repetir esta observação três minutos depois.
Interpretação
O indicador de couve-roxa fica verde quando o pH aumenta. Esta alteração de cor, em conjunto com o odor a amónia, pode ser detectada num tubo com a enzima e o seu substrato. Nos tubos que contêm apenas a enzima ou o substrato, o pH mantém-se estável e, por isso, o indicador de couve-roxa continua violeta.
Segurança
Aproximadamente 1% das crianças podem ser alérgicas ao extracto de feijão de soja (ver McGee, 2004). Aconselha-se que os professores se assegurem que nenhum dos alunos é afectado antes de usar este protocolo.
Investigações adicionais
Uma experiência complementar poderia ser realizada para investigar os factores que influenciam a actividade enzimática (tais como a temperatura, pH e as concentrações de enzima, substrato e produto).
Agradecimentos
Este protocolo experimental foi elaborado por Anna Lorenc do projecto Volvox, criado pelo ‘Sixth Framework Programme’ da Comissão Europeia.
O projecto Volvox
A equipa do projecto Volvox é um grupo de professores de biologia e especialistas de dez países da União Europeia, que visa fornecer aos professores de biologia do ensino secundário e outros, protocolos laboratoriais, simulações e actividades de sala de aula comprovadas e numerosos outros recursos educacionais. Ver www.eurovolvox.org
References
- Ainsworth C (2008) Locking the cradle. Science in School 8: 25-28. www.scienceinschool.org/2008/issue8/rabies
- McGee H (2004) On food and cooking. London, UK: Hodder & Stoughton. ISBN: 0340831499
Review
A actividade enzimática é frequentemente investigada através da acção da amilase sobre o amido, estabelecendo ligação com a alimentação e a nutrição. O método simples aqui apresentado constitui uma boa alternativa, com ligação ao ciclo do azoto, o qual pode ser um conceito difícil para os alunos compreenderem. A ideia de usar um indicador natural, que pode ser isolado pelos alunos, torna a aula mais divertida. Além disso, os alunos podem cheirar o produto da reacção devido à libertação de amónia! Os factores que influenciam a actividade enzimática poderiam ser investigados como trabalho de grupo, discutido numa sessão plenária.
O artigo poderia ser usado para verificar a compreensão colocando questões como:
- Porque são as folhas de couve colocadas em água a ferver?
- Para que cor muda o indicador se a amónia estiver presente na solução?
- Descreva o que observaria se tivesse usado extracto de feijão de soja fervido e justifique essa observação.
- Indique qual dos tubos de ensaio é o tubo controle da experiência. Explique o isso significa e o que esperaria observar neste tubo.
Shelley Goodman, Reino Unido





