Dziura w niebie Understand article
Tłumaczenie Katarzyna Królik. Ćwierć wieku temu odkrycie dziury w warstwie ozonowej miało przełomowe znaczenie. Tim Harrison i Dudley Shallcross sprawdzają, co zmieniło się od tamtej pory.
Odkrycie dziury ozonowej
uprzejmości the Goddard
Space Flight Center Scientific
Visualization Studio
Jeden z odkrywców dziury ozonowej – Jonathan Shanklin wspomina, że do jej odkrycia doszło przypadkiem. Kiedy w 1977 roku dołączył do grupy badawczej British Antarctic Surveyw1, miał zająć się komputerowym opracowaniem sporządzonych ręcznie pomiarów. Jak się później okazało, lata 70. były okresem, w którym odnotowano stopniowy spadek koncentracji ozonu.
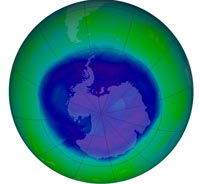
ozonowej nad Antarktyką w
ciągu roku z dnia 12
września 2008 roku
obejmował ponad 27
milionów kilometrów
kwadratowych. Według
organizacji NASA jest to
dziura ozonowa o
umiarkowanej wielkości.
Zdjęcia dzięki uprzejmości
NASA
Już wcześniej pojawiały się obawy, że chlorofluorowęglowodory (CFC – ang. chlorofluorocarbons) – związki organiczne, takie jak trichlorofluorometan (CFCl3) oraz dichlorodifluorometan (CF2Cl2), używane wówczas powszechnie jako czynnik chłodniczy, gaz nośny (w pojemnikach aerozolowych) lub rozpuszczalnik – mogą niszczyć warstwę ozonową. Podczas dnia otwartego w 1983 roku Shanklin przygotował wykres, na którym zaznaczył z pewną ironią, że dane dotyczące ozonu właściwie nie zmieniły się na przestrzeni ostatnich 20 lat. Mimo że dotyczy to całej warstwy ozonowej, zauważył on, że z roku na rok w okresie wiosennym odnotowuje się coraz większy spadek stężenia ozonu. Dalsze badania potwierdziły te spostrzeżenia, co doprowadziło do publikacji wniosku: każdej wiosny na półkuli południowej powstaje dziura w warstwie ozonowej nad Antarktyką, wywołana prawdopodobnie przez CFC, która ciągle się powiększa (Farman et al., 1985).
Jaki związek ma z tym chemia i dlaczego dziura ozonowa stanowi zagrożenie?
Ozon w stratosferze
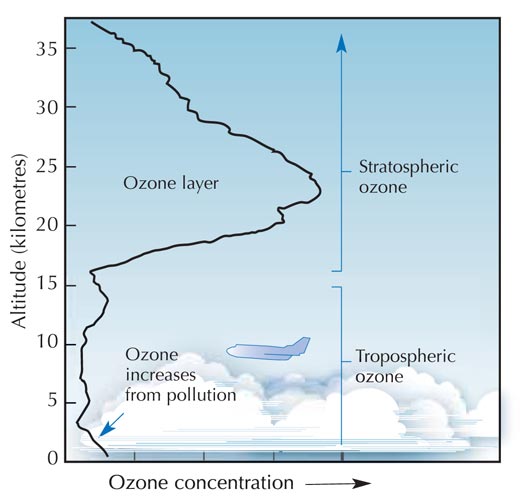
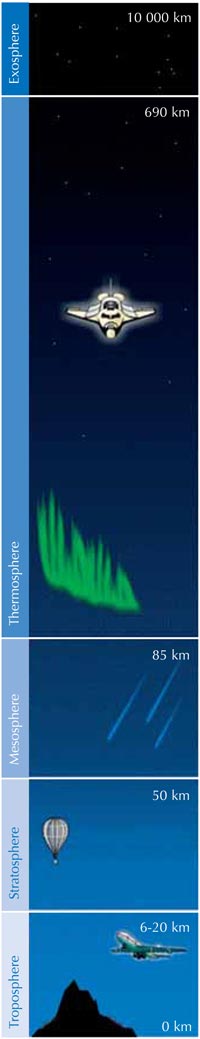
Ozon (O3)jest znacznie mniej trwałą trzycząsteczkową odmianą tlenu (O2). Ten jasnoniebieski gaz znajduje się w niewielkim stężeniu w całej atmosferze, jednak posiada zarówno ochronne, jak i szkodliwe właściwości: w troposferze (rysunek poniżej), stanowi zanieczyszczenie, które może mieć szkodliwy wpływ na rośliny oraz układ oddechowy człowieka i zwierząt. Warstwa ozonowa występująca w stratosferze pełni natomiast funkcję ochronną, chroniąc powierzchnię Ziemi poprzez zatrzymywanie większości szkodliwego promieniowania ultrafioletowego (UV) emitowanego przez Słońce.
Najwyższe stężenie ozonu występuje w stratosferze, drugiej pod względem grubości warstwy atmosfery ziemskiej (na wysokości ok. 10-55 km; patrz zdjęcie), Ozon powstaje w wyniku procesu fotochemicznego:
O2 + hν → O• + O• λ ~ 200 nm (1)
O• + O2 + M → O3 + M (2)
Własność publiczna; źródło zdjęcia: Wikimedia Commons
Cząsteczka tlenu (O2) wchłania foton promieniowania UV (hν) o długości fali (l) ok. 200 nm i ulega rozpadowi na dwa atomy tlenu (O•) (reakcja 1). Każdy z atomów powstałych w wyniku rozpadu może łączyć się z inną cząsteczką tlenu, co doprowadzi do powstania cząsteczki ozonu. Jednak aby do tego doszło, reakcji musi towarzyszyć wystarczająco wysokie ciśnienie (M) – ok. 0,01 atmosfery, które utrwali nowo powstałą cząsteczkę ozonu (reakcja 2). Im wyżej, tym reakcja 1 zachodzi szybciej (poniżej wysokości 20 km nie występują fotony o długości fali 200 nm, ponieważ zostają wchłonięte podczas reakcji 1). Natomiast reakcja 2 przebiega szybciej bliżej powierzchni Ziemi, gdzie ciśnienie atmosferyczne jest wyższe. W związku z tym, największa ilość ozonu powstaje na wysokości ok. 25-30 km (patrz wykres).
Stratosfera pełni dwie istotne role warunkujące życie na Ziemi. Po pierwsze, ozon pochłania wysokoenergetyczne promieniowanie UV w zakresie długości fali ok. 250 nm (reakcja 3):
O3 + hν → O• + O2 λ ~ 250 nm ΔH = – 90 kJ mol-1 (3)
Podczas tych reakcji, tlen (reakcja 1) oraz ozon (reakcja 3) filtrują z atmosfery krótkofalowe promieniowanie UV o długości fali 200 – 300 nm, które w przeciwnym razie stanowiłoby zagrożenie dla życia na Ziemi.
Po drugie, w wyniku reakcji 3 powstaje duża ilość ciepła, czyniąc stratosferę znacznie cieplejszą warstwą niż górna część troposfery (rysunek poniżej), co sprawia, że warunki pogodowe troposfery są znacznie łagodniejsze.
Reakcje 2 i 3 z udziałem atomów tlenu oraz ozonu zachodzą w bardzo krótkim czasie. Kolejna reakcja wymagająca więcej czasu niż dwie poprzednie prowadzi do rozpadu cząsteczki ozonu i tlenu i powstania dwóch cząsteczek tlenu:
O• + O3 → O2 + O2 (4)
Reakcje 1-4 zostały podsumowane na poniższym diagramie.
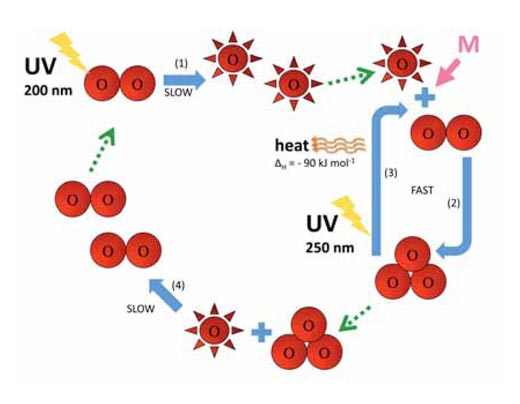
Zdjęcia dzięki uprzejmości Marlene Rau
Naturalne procesy katalityczne niszczą warstwę ozonową
W 1995 roku Paul Crutzen, Mario Molina oraz F Sherwood Rowland otrzymali Nagrodę Nobla w dziedzinie chemii za pracę nad procesem powstawania i rozpadu ozonu w stratosferze. Co udało się ustalić badaczom w wyniku przeprowadzonych badań? W latach 70. Crutzen et al. odkryli obecność naturalnych katalizatorów, które przyspieszają przebieg reakcji 4 oraz zmniejszają poprzez to stężenie ozonu w stratosferze (Crutzen, 1970, 1971): woda (H2O), metan (CH4), podtlenek azotu (N2O) lub chlorometan (CH3Cl) które uwalniane są do atmosfery w procesach biologicznych zachodzących na powierzchni Ziemi, co prowadzi co powstania wolnych cząsteczek, takich jak grupa wodorotlenowa (OH•), tlenek azotu (NO•) lub chlor (Cl•), które pełnią funkcję katalizatora w procesie rozpadu ozonu.
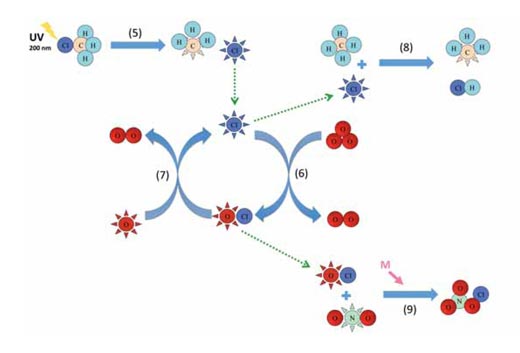
Zdjęcia dzięki uprzejmości Marlene Rau
Reakcja 5 przedstawia proces rozpadu chlorometanu, podczas którego rodniki chloru uwalniane są do stratosfery pod wpływem fotolizy, natomiast reakcje 6 i 7 stanowią przykład procesu katalitycznego (patrz diagram powyżej). Reakcje z udziałem pozostałych katalizatorów zachodzą w sposób analogiczny do reakcji 6 i 7. Chlorometan również jest częściowo uwalniany przez organizmy wodne i lądowe, np. czerwone makroglony, grzyby białej zgnilizny drewna oraz inne rośliny wyższe, w celu regulowania poziomu jonów chlorku w ścianach komórkowych, które po 30-40 latach mogą dotrzeć do górnej części stratosfery (na wys. ok. 40 km), gdzie w wyniku fotolizy zostaną rozłożone przez promieniowanie słoneczne.
CH3Cl + hν → •CH3 + Cl• l ~ 200 nm (5)
Powstały w wyniku reakcji wolny rodnik chloru (Cl•) może brać udział w procesie katalitycznym:
Cl• + O3 → ClO• + O2 (6)
ClO• + O• → Cl• + O2 (7)
Obie reakcje 6 i 7 przebiegają na tej samej zasadzie co reakcja 4, jednak w znacznie szybszym tempie – w przypadku wolnego rodnika chloru/tlenku chloru (ClO•) – aż 30 tys. razy szybciej. A zatem dlaczego opisane powyżej procesy katalityczne nie niszczą całego ozonu? Otóż proces ten może zostać przerwany poprzez stworzenie trwałych cząsteczek:
Cl• + CH4 → •CH3 + HCl (8)
ClO• + •NO2 + M → ClONO2 + M (9)
W końcu jednak może się zdarzyć, że wolny rodnik chloru napotka cząsteczkę metanu i w wyniku reakcji powstanie kwas solny (HCl, reakcja 8). Podobna reakcja może zajść pomiędzy rodnikiem tlenku chloru a dwutlenkiem azotu, tworząc azotan chloru (ClONO2, reakcja 9). Jest to kolejna reakcja, która łatwiej zachodzi na niższych warstwach atmosfery. Zarówno kwas solny, jak i azotan chloru należą do bardzo trwałych związków, a brak chloru oraz tlenku chloru powoduje przerwanie procesu katalitycznego.
w stratosferze według WMO
/ UNEP Scientific Assessment
of Ozone Depletion,1998.
Kliknij na obrazek aby
powiększyć
Zdjęcia dzięki uprzejmości
Andrew Ryzhkov; źródło
zdjęcia: Wikimedia Commons
Tajemnicza dziura ozonowa nad Antarktyką
Dopiero niedawno naukowcy odkryli, że CFC mogą wywoływać podobny katalityczny proces rozpadu ozonu: 1974 roku Molina i Rowland nie tylko ostrzegli, że wzrost CFC wymknął się spod kontroli, ale także przewidzieli, że CFC przyczynia się w dużej mierze do dodatkowej straty ozonu na wysokości 40 km (patrz Molina & Rowland, 1974). Jednak w chwili odkrycia dziury ozonowej w 1985 r., zanik ozonu został zauważony nad Biegunem Południowym w okresie wiosennym już na wysokości 20 km (patrz Farman et al., 1985).
Wkrótce spostrzeżenia te stały się faktem , że to właśnie wolne rodniki CFC są odpowiedzialne za niszczenie warstwy ozonowej, jednak nadal wiele pytań pozostało bez odpowiedzi. Dlaczego dziura ozonowa powstaje właśnie nad Biegunem ? Jeżeli występuje ona nad Biegunem Południowym, dlaczego nie ma jej nad Biegunem Północnym? Dlaczego jest widoczna tylko w okresie wiosennym? I dlaczego dziura ozonowa występuje na wysokości 20 km, a nie 40 km, jak wcześniej przewidywano? Przecież CFC nie mogą być rozłożone przez promieniowanie słoneczne na wysokości 20 km, gdzie gęstość fotonów jest niewystarczająca. Z tego samego powodu, na tej wysokości nie ma też wystarczająco dużo atomów tlenu potrzebnego, aby zaszła reakcja 7. Wiele lat późniejszej pracy pozwoliło stworzyć pełniejszy obraz tego zagadnienia.

Zdjęcia dzięki uprzejmości Dudley Shallcross, Tim Harrison, Marlene Rau и Nicola Graf
Wolne rodniki chloru uwolnione z CFC, np.
CFCl3 + hν → •CFCl2 + Cl• l ~ 200 nm (10)
mogłyby reagować z metanem (reakcja 8), tworząc kwas solny lub z ozonem (reakcja 6), tworząc rodnik tlenku chloru, a następnie w wyniku reakcji 9 mogłoby dojść do utworzenia azotanu chloru. Taki łańcuch reakcji mógłby doprowadzić do zwiększenia koncentracji kwasu solnego oraz azotanu chloru na wysokości ok. 40 km nad powierzchnią Ziemi.
Własność publiczna; źródło
zdjęcia: Wikimedia Commons
Każdej zimy na półkuli południowej, Biegun Południowy jest spowity ciemnością przez niemal 3 miesiące. Powietrze stratosferyczne ponad Biegunem Południowym ochładza się, a bez promieniowania UV nie może zajść reakcja 3, ponieważ nie jest uwalniane ciepło. Wiatr ten jest spychany, a ruchy Ziemi powodują tworzenie się wiru podobnego do wiru spływającej w umywalce wody. Wir ten jest tak silny, że chwyta różne substancje, ale nie wypuszcza ich. Bogaty w kwas solny oraz azotan chloru wiatr z wysokości 40 km zostaje zepchnięty do mroźnego ciemnego wiru.
Pod wpływem bardzo niskiej temperatury polarnej zimy, wir powietrza ochładza się do tego stopnia, że poniżej -78°C (195 K) na wysokości 15-25 km stratosferyczne chmury polarne przekształcają się z wody i/lub kwasu w kryształki lodu.
Jedną z ciekawostek chemicznych jest fakt, że kwas solny oraz azotan chloru mogą wiązać się cząsteczkami stratosferycznych chmur polarnych i następnie brać udział w różnorodnych szybkich reakcjach zarówno w postaci gazowej, jak i trwałej tworząc kwas azotowy (HNO3) który zostaje wchłonięty przez lodowe kryształki, podczas gdy chlor (Cl2) zostaje uwolniony w postaci gazu.
HCl + ClONO2 → HNO3 + Cl2 stratosferyczne chmury polarne (11)
Powyższa reakcja może zachodzić przez okres całej zimy, jeśli tylko temperatura jest wystarczająco niska, aby utworzyć stratosferyczne chmury polarne. Jednak wraz z nadejściem wiosennego Słońca, duża ilość chloru ulega rozpadowi w procesie fotolizy, tworząc rodniki chloru:
Cl2 + hν → Cl• + Cl• l ~ 350 nm (12)
a następnie rodniki tlenku chloru w reakcji 6:
Jednak w trakcie wiosny na Biegunie, reakcja 7 (powstawanie rodników chloru oraz cząsteczek tlenu w wyniku reakcji rodników tlenku chloru oraz rodników tlenu) przebiega bardzo wolno, ponieważ ze względu na brak fotonów o dł. fali 200 nm na tej wysokości, występuje tam znikoma ilość tlenu. W tym miejscu dochodzimy co drugiej ciekawostki chemicznej. Tlenek chloru w niskiej temperaturze, np. wiru polarnego (który mimo wiosny nadal utrzymuje temperaturę), może tworzyć dimer – nadtlenek chloru (ClOOCl):
ClO• + ClO• → ClOOCl (13)
Dimer jest nietrwałym związkiem w temperaturze pokojowej, ale dosyć łatwo reaguje w niskiej temperaturze (poniżej -30 °C) i może brać udział w procesie fotolizy:
ClOOCl + hν → Cl• + O2 + Cl• l ~ 300 nm (14)
Zatem nawet jeśli reakcja 7 nie może zajść, to podczas reakcji 14 ponownie zostają uwolnione wolne rodniki chloru, które przy udziale promieni słonecznych ponownie rozpoczynają katalityczny rozkład ozonu.
Czym więc różni się ta reakcja od naturalnych procesów katalitycznych, które omawialiśmy wcześniej? Dlaczego na pewnych wysokościach wiru następuje całkowity zanik ozonu? Po pierwsze, reakcja 8 (podczas której wolne rodniki chloru zostają usunięte, przez co następuje przerywanie procesu rozpadu ozonu), przebiega bardzo wolno w niskiej temperaturze wiru, dlatego też jest mało skuteczna. Poza tym cały dwutlenek azotu potrzebny w reakcji 9 (która również mogłaby zakończyć proces rozkładu poprzez utworzenie ClONO2) został przetworzony podczas zimy w kwas azotowy (np. w reakcji 9 i 11) i nie można go ponownie wytworzyć, ponieważ wir polarny jest izolowany przed dopływem świeżego powietrza (u podłoża wiru powietrze przepływa od Bieguna Południowego w kierunku równika, gdzie następuje wstępujący ruch mas powietrza). W rezultacie, nie można powstrzymać cyklu rozpadu ozonu, co prowadzi do całkowitego jego zaniku na tym poziomie. W dalszej kolejności brak ozonu uniemożliwia reakcję 3, która mogłaby ocieplić ten region, co pozwala, aby wir „dotrwał” do wiosny, kiedy nasili rozkład ozonu.

Asker, Norway
Własność publiczna; źródło
zdjęcia: Wikimedia Commons
Jedynym powodem istnienia większej dziury ozonowej nad Biegunem Południowym niż na Północnym jest fakt, że wiosenna temperatura stratosfery jest nieco wyższa nad Biegunem Północnym, co jest uwarunkowane większą ilością pasm górskich na średnich i wysokich szerokościach geograficznych Półkuli Północnej, które mają wpływ na przepływ mas powietrza, przez co jest dużo mniej stratosferycznych chmur polarnych.
Późną wiosną, napływ mas powietrza bogatego w ozon w końcu ogrzewa wir poprzez reakcję 3, powodując zanik wiru polarnego. W tym momencie ponownie możliwy jest ruch mas powietrza z innych części atmosfery, dzięki czemu dziura ozonowa zostaje wypełniona przez ozon.
W niektórych okresach dziura ozonowa nad Antarktyką osiągała tak duże rozmiary, że swym zasięgiem obejmowała nawet Australię, Nową Zelandię, Chile i Argentynę, rozciągając się na powierzchni 1,5 razy większą niż terytorium Stanów Zjednoczonych, co sprawiało, że podczas rozpadu ozonu, masy powietrza ubogiego w ozon docierały nad obszary zaludnione, nawet do Afryki Południowej. Stanowiło to bezpośrednie zagrożenie dla zdrowia ludzi zamieszkujących te tereny. Największym zagrożeniem jest nadmierna ekspozycja na promieniowanie UV, która może wywołać nowotwór skóry, zaćmę koro wą, a także uszkodzić system immunologiczny. Poza tym, nadmierne promieniowanie UV niszczy rośliny oraz materiały budowlane.
CFC i ozon dzisiaj
Obecnie mamy świadomość na temat procesów fizyczno-chemicznych, które zachodzą w warstwie ozonowej.
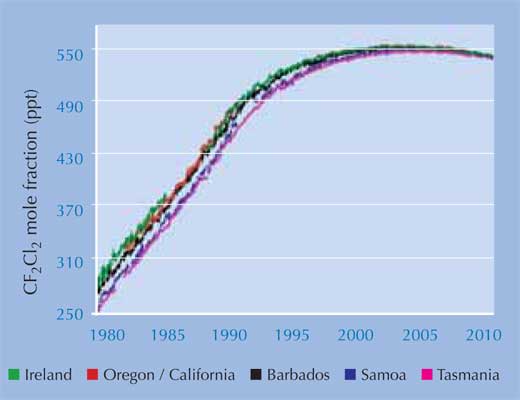
Zdjęcia dzięki uprzejmości the AGAGE project
W chwili, gdy szkodliwy wpływ CFC w procesie rozkładu ozonu stał się faktem, rządy państw wprowadziły szereg przepisów, które zakazują używania CFC, zastępując je alternatywnymi mniej trwałymi związkami chemicznymi (węglowodór chloru i oraz węglowodory fluorochlorowe), stosowanie których również zamierza się stopniowo ograniczać. Przepisy te zostały zawarte w Protokole Montrealskim z 1987 roku, zwłaszcza w zmianach z 1990 i 1992 roku, które przyspieszyły zaprzestanie stosowania tych związków chemicznych, co było ogromnym osiągnięciem w dziedzinie ochrony środowiska.
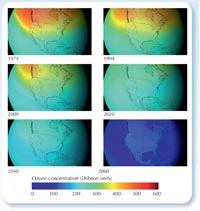
ozonowa, jeśli stosowanie
CFC nie zostałoby
zabronione. Kliknij na
obrazek aby powiększyć
NASA images courtesy of the
Goddard Space Flight Center
Scientific Visualization Studio
Ostatnie wyniki badań opublikowane przez AGAGE (the Advanced Global Atmospheric Gases Experiment)w2, które dotyczyły pomiaru poziomu CFC i ich zamienników od 1978 roku, wykazały, że nawet poziom obecnego w atmosferze najtrwalszego CFC – dichlorodifluorometanu (CF2Cl2), najtrwalszego zaczął spadać. Zapewne jest to sukces ustanowionego prawodawstwa (patrz lewa strona). Mimo że dziura ozonowa nadal tworzy się nad Biegunem Południowym w okresie wiosennym, to szacuje się, że problem ten zniknie do 2050 roku, a do 2080 roku stężenie ozonu wróci do stanu z 1950 roku.
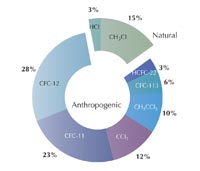
Przyczyną powstawania dziury ozonowej jest powszechne stosowanie CFC od ok. 1930 roku, które, podobnie jak inne gazy, w ciągu 30- 40 lat docierają do górnej części stratosfery, co potwierdza, że CFC niewątpliwie miały szkodliwy wpływ na warstwę ozonową. Obecnie towarzyszy nam najwyższy poziom stężenia chloru w atmosferze, co jest spowodowane masowym stosowaniem CFC w latach 80., ale poziom ten powinien stopniowo spadać w ciągu najbliższych lat.
Mimo, że proces odbudowy warstwy ozonowej przebiega w wolnym tempie, to zdecydowanie udało się zapobiec katastrofie. Naukowcy obliczyli, że jeżeli wzrost stosowania CFC utrzymałby się na poziomie 3% rocznie, doprowadziłoby to do powstania dziury ozonowej nad całą powierzchnią Ziemi do 2060 roku, co wiązałoby się z problemami zdrowotnymi. (patrz po prawej stronie; Newman et al., 2009).
Prawdopodobnie najważniejszą lekcją dotyczącą dziury ozonowej, z której należy wyciągnąć odpowiednie wnioski, jest uświadomienie sobie jak olbrzymi wpływ na zmiany zachodzące na naszej planecie (zwykle na gorsze, ale również na lepsze) ma działalność człowieka. Jednak trzeba pamiętać, że zmiany na lepsze powinny zostać wprowadzane wspólnie, skutecznie i szybko.
References
- Crutzen PJ (1970) Influence of nitrogen oxides on atmospheric ozone content.Quarterly Journal of the Royal Meteorological Society 96: 320-325. doi:10.1002/qj.49709640815
- Crutzen PJ (1971) Ozone production rates in an oxygen-hydrogen-nitrogen oxide atmosphere. Journal of Geophysical Research 76(30): 7311-7327. doi:10.1029/JC076i030p07311
- Farman JC, Gardner BG, Shanklin JD (1985) Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction. Nature 315: 207-210. doi:10.1038/315207a0
-
Bezpłatny dostęp do artykułu na stronie internetowej Nature (www.nature.com) or via the direct link: http://tinyurl.com/2wemxhn
-
- Molina MJ, Rowland FS (1974) Stratospheric sink for chlorofluoromethanes – chlorine atomic-catalysed destruction of ozone. Nature 249: 810-812. doi:10.1038/249810a0
-
Bezpłatny dostęp do artykułu na stronie internetowej Nature (www.nature.com) lub za pomocą linku: http://tinyurl.com/2u69cul
-
- Newman PA et al. (2009) What would have happened to the ozone layer if chlorofluorocarbons (CFCs) had not been regulated? Atmospheric Chemistry and Physics 9: 2113-2118. doi: 10.5194/acp-9-2113-2009
- Patterson L (2010) A chemical bond: Nick Barker, linking schools and universities in the UK. Science in School 15.
- Veneu-Lumb F, Costa M (2010) Using news in the science classroom. Science in School 15: 30-33.
Web References
- w1 –The British Antarctic Survey jest odpowiedzialne za działalność naukową UN (Zjednoczonego Królestwa Wielkiej Brytanii i Irlandii Północnej) na Antarktyce. Patrz: www.antarctica.ac.uk
- w2 – The Advanced Global Atmospheric Gases Experiment, AGAGE to dotowana przez organizację NASA stacja badawcza, która bada skład atmosfery ziemskiej nieprzerwanie od 1978 roku, badając m. in. CFC oraz większość gazów cieplarnianych (poza CO2) wymienionych w protokole z Kyoto. Wyniki badań na stronie internetowej: http://agage.eas.gatech.edu
Resources
- Sidney Chapman jako pierwszy opisał sposób powstawania i rozpadu ozonu w procesie fotolizy. Patrz:
-
Chapman S (1930) On ozone and atomic oxygen in the upper atmosphere.Philosophical Magazine Series 7 10(64): 369-383. doi: 10.1080/14786443009461588
-
- Jonathan Shanklin, jeden z odkrywców dziury ozonowej, opublikował swoje spostrzeżenia dopiero 25 lat później:
-
Shanklin J (2010) Reflections on the ozone hole. Nature 465: 34-35. doi: 10.1038/465034a
-
Pobierz bezpłatny artykuł lub zamów prenumeratę Nature już dzisiaj na: www.nature.com/subscribe
-
- W czasopiśmie Nature został opublikowany szereg artykułów na temat stratosfery oraz dziury ozonowej i jej odkrycia, niektóre z nich są dostępne bezpłatnie na: www.nature.com/nature/focus/ozonehole
- Na stronie internetowej NASA’s Ozone Hole Watch znajdują się mapy dotyczące poziomu ozonu, informacje dotyczące ozonu oraz galeria multimedialna, materiały dydaktyczne na ten temat, itp. Patrz: http://ozonewatch.gsfc.nasa.gov
- Na The University of Cambridge, UK, stworzono wirtualną wypra wę wgłąb dziury ozonowej, jej historii i nauki. Dostępna w wersji angielskiej, francuskiej oraz niemieckiej na: www.atm.ch.cam.ac.uk/tour
- 74 naukowców uczestniczących w sympozjum naukowym dotyczącym pomiaru ozonu, które odbyło się w Les Diablerets w Szwajcarii w 2002 roku, opublikowało 20 Questions and Answers about the Ozone Layer dotyczące m.in. procesów zachodzących na powierzchni Ziemi oraz podczas erupcji wulkanów. Patrz: www.gcrio.org lub za pomocą linku: http://tinyurl.com/2wpvf9r
- Introduction to Atmospheric Chemistry autorstwa profesora Harvard University – Daniela J Jacoba dosteny bezpłatnie w formacie PDF zawiera rozdział dotyczący ozonu wraz z diagramem ‘Chronology of the ozone hole’(rozdział 10.3.3.) Patrz: http://acmg.seas.harvard.edu/peoplelub za pomocą linku: http://tinyurl.com/39vhy6a
- Ozzy Ozone należy do United Nations Environment Programme strona internetowa, na której można znaleźć wiele kreskówek oraz gier edukacyjnych, glosariuszy, itp. Ze strony można pobrać zestawy edukacyjne zawierające podręcznik dla uczniów i nauczycieli zarówno dla szkoły podstawowej, jak i wyższej. Wszystkie materiały dostępne są w języku angielskim, francuskim i hiszpańskim. Patrz: www.ozzyozone.org
- obszerne opracowanie można także znaleźć na stronie internetowej The Ozone Depletion utworzonej przez naukowca Roda Jenkinsa: www.ozonedepletion.info
- Strona internetowa the United Nations Environment Programme’s OzonAction oferuje ogromną ilość danych i informacji dotyczących ozonu i Protokołu Montrealskiego. Patrz: www.unep.fr/ozonaction
-
Warto również odwiedzić stronę internetową sekretariatu United Nations Environment Programme Ozone w języku angielskim, francuskim i hiszpańskim: http://ozone.unep.org
-
- NASA przedstawia także dwa filmy dostępne online o zmianach atmosferycznych nad Antarktyką na podstawie badań the Upper Atmosphere Research Satellite (UARS).
-
Na stronie internetowej www.nasaimages.org lub za pomocą linku:http://tinyurl.com/2w6wgh4 można śledzić wzrastające stężenie azotanu chloru na przełomie lutego i marca w 1993 roku.
-
Film przedstawia proces tworzenia się stratosferycznych chmur polarnych. Patrz: www.nasaimages.org lub za pomocą linku:http://tinyurl.com/33dfn6e
-
- Poza tym, NASA opublikowała zdjęcia ukazujące etapy istnienia dziury ozonowej. Patrz: www.nasa.gov/vision/earth/lookingatearth/25TOMSAGU.html
Review
Kwestia dziury ozonowej zalicza się do głównych światowych problemów, a ten artykuł przybliża istotę tego zagadnienia. Autor bardzo dokładnie opisuje procesy chemiczne prowadzące do powstania dziury ozonowej. Artykuł może zostać wykorzystany na lekcjach chemii do nauki o budowie atomu oraz związków chemicznych, wolnych rodników oraz przebiegu procesów katalitycznych oraz o wpływie promieniowania oraz temperatury na przebieg reakcji chemicznych.
Podczas omawiania nauki o Ziemi artykuł może być pomocny w następujących zagadnieniach:
- Wpływ atmosfery na klimat.
- Procesy biologiczne zachodzące na powierzchni Ziemi oraz wpływ organizmów wodnych.
- Morfologia Ziemi oraz rozmieszczenie pasm górskich.
- Zmiana pór roku, nachylenie osi Ziemi oraz obroty kuli ziemskiej.
Można również połaczyć chemię z nauką o Ziemi. Oto przykładowe tematy:
- Rozmieszczenie organizmów wytwarzających związki chemiczne uzestniczące w naturalnych procesach katalitycznych. Gdzie takie organizmy żyją? Jakie substancje chemiczne produkują?
- Skład chemiczny atmosfery oraz wpływ na klimat. Jakie gazy wchodzą w skład atmosfery ? W jaki sposób właściwości atmosfery ziemskiej wpływają na warunki klimatyczne na powierzchni Ziemi? Czym różnią się one od warunków na innych planetach?
Artykuł może także służyć dyskusji na temat sposobu przedstawiania nauki w mediach. Uczniowie mogą porównać artykuł z innymi dostępnymi w prasie ogólnej i poszukać odpowiedzi na pytania: czy przedstawiają one pełny obraz, opisując zarówno wpływ procesów chemicznych, jak i naturalnych? Czy całość problemu jest wyolbrzymiana czy bagatelizowana? Dalczego ? Czy jest to spowodowane ignorancją dziennikarzy czy strategii politycznej, czy obu stron ? Więcej ciekawostek ze świata nauki można znaleźć w Veneu-Lumb & Costa (2010).
Przykładowe pytania na podsumowanie tekstu:
- Dlaczego ten temat tak często powraca w dyskusjach ?
- Jaki wpływ na powiększanie się dziury ozonowej mają czynniki naturalne? Jaki jest udział człowieka?
Teresa Celestino, Włochy





