Sneller, goedkoper, CRISPR: de nieuwe revolutie in de gentechnologie Understand article
Vertaald door Edith van der Have-Raats, Biollandica. Een controversiële nieuwe technologie maakt gen-editing veel goedkoper en makkelijker – te makkelijk, misschien?

Graf
Je typt een zin en ziet dat er een letter niet klopt. Door de fout krijgt de zin een andere betekenis, dus je plaatst de cursor bij de foute letter, drukt op backspace en voegt de juiste letter in. Dat gaat buitengewoon makkelijk. Ongelooflijk, maar deze simpele handeling wordt nu ook toegepast in het laboratorium, met de onderzoeker als auteur en DNA als de boodschap die wordt veranderd.
Dit is mogelijk met CRISPR-Cas9, een nieuwe technologie die de wetenschap in de afgelopen paar jaar heeft veroverd. Deze technologie biedt belangrijke biomedische voordelen, maar stelt ons nu ook voor enkele lastige problemen. Er is al zoveel aandacht in de media voor deze controversiële technologie dat je als biologiedocent kunt rekenen op lastige vragen van je leerlingen over CRISPR-Cas9. Daarom volgt hier een korte leidraad over wat CRISPR-Cas9 is en waarom het belangrijk is.
Wat is CRISPR–Cas9?
CRISPR-Cas9 wordt door bacteriën gebruikt om zich te beschermen tegen aanvallen van virussen. De laatste tijd wordt dit systeem gebruikt als technologie om een genoom precies op een bepaalde plaats te kunnen knippen. Het systeem bestaat uit twee onderdelen: CRISPR en Cas9. CRISPR is de afkorting van ‘clustered regularly interspaced short palindromic repeats’ (geclusterde, op regelmatige afstand van elkaar gelegen, korte palingdromische herhalingen). Het gaat om plaatsen in het genoom waar de DNA-sequentie wordt herhaald. In de buurt van deze herhalingen liggen Cas-genen, die coderen voor belangrijke enzymen in het systeem. Een daarvan, Cas9, is een nuclease, dus een enzym dat nucleïnezuren (DNA of RNA) knipt.
Als een virus een bacterie aanvalt, injecteert het zijn nucleïnezuur in de bacterie. Deze reageert door Cas-enzymen te produceren, waarmee stukjes van het virale nucleïnezuur worden uitgeknipt en ingebouwd op de CRISPR-locaties in het eigen genoom van de bacterie (figuur 1). Dat levert de bacterie nuttige specifieke immuniteit op. Als de bacterie nogmaals wordt aangevallen door hetzelfde soort virus, worden de CRISPR-locaties samen met het virale nucleïnezuur gekopieerd naar korte RNA-moleculen. Deze korte RNA-moleculen binden zich eerst aan het Cas9-enzym en begeleiden vervolgens het zo ontstane complex naar het binnendringende nucleïnezuur, dat geïdentificeerd wordt doordat het een passende sequentie heeft. Cas9 knipt dat nucleïnezuur, waardoor het virus de bacterie niet kan kapen voor zijn eigen replicatie.
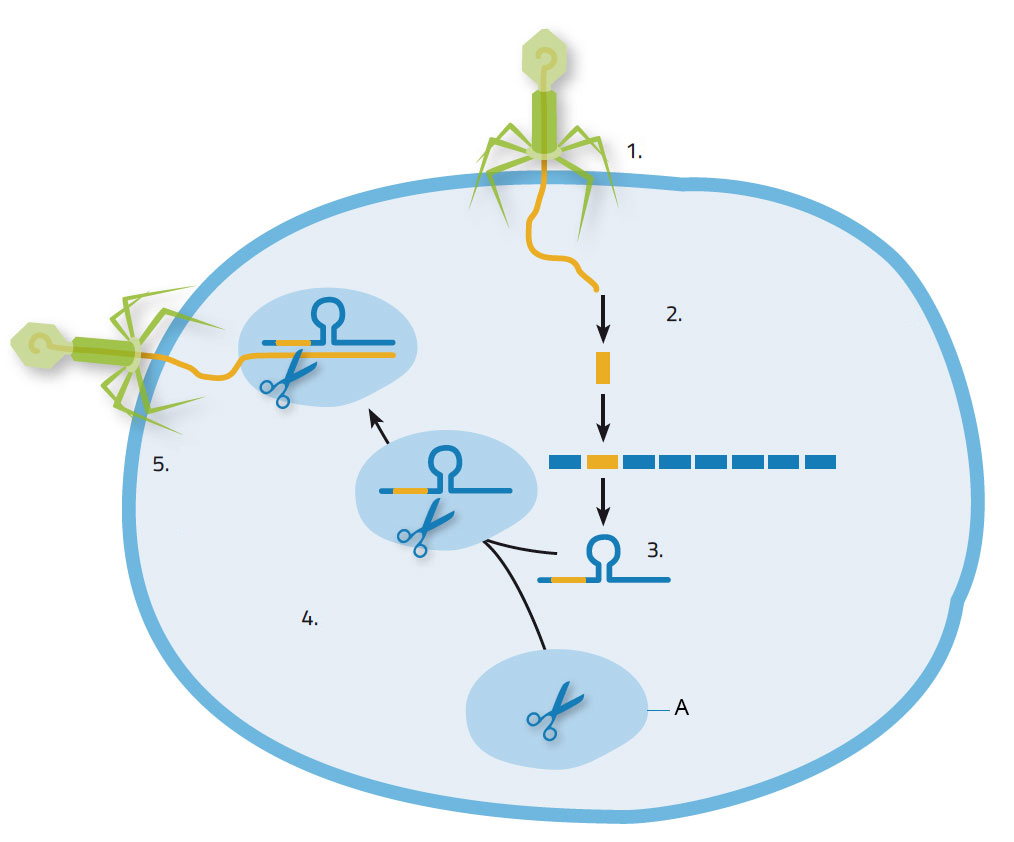
1. Virus dringt binnen in bacteriecel 2. Nucleïnezuur uit virus wordt ingebouwd in bacterieel nucleïnezuur op CRISPR-locatie; 3. Er wordt CRISPR-RNA gevormd; 4.CRISPR-RNA bindt zich aan Cas9-enzym; 5. CRISPR-RNA begeleidt het Cas9-enzym naar het virus. Cas9 knipt en vernietigt het virale genoom.
Figuur met dank aan Nicola Graf
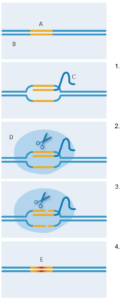
CRISPR-Cas9.
A: Doelsequentie;
B: DNA;
C: Guide RNA (begeleidend RNA);
D: Cas9; E: Nieuwe DNA-sequentie.
1. Guide RNA bindt zich aan
doelsequentie van DNA;
2. Cas9-enzym bindt zich
aan guide RNA;
3. Cas9-enzym knipt beide
DNA-strengen;
4. Het bacteriële
reparatiesysteem voegt
nieuw DNA in bij de
strengbreuken, waarbij de
oorspronkelijke
DNA-sequentie wordt
vervangen.
Figuur met dank aan Nicola
Graf
Maar hoe is dit bacteriële systeem aangepast om een nieuwe genetische techniek op te leveren? In 2012 hebben de teams van Jennifer Doudna aan de Universiteit van Californië – Berkeley (VS) en Emmanuelle Charpentier, toen aan de Universiteit van Umeå (Zweden), de korte RNA-moleculen gewijzigd en samengevoegd tot één ‘begeleidend’ RNA-molecule (guide RNA) (figuur 2). Het uiteinde dat aan Cas9 kon binden werd behouden, maar de sequenties aan het andere uiteinde konden zo gemaakt worden dat ze zich bonden aan elk doel-DNA met een bekende sequentie. Door deze aanpassing kon CRISPR-Cas9 specifieke DNA-sequenties naar keuze knippen. Kort daarna werd de technologie verder ontwikkeld in het laboratorium van Feng Zhang aan het Massachusetts Institute of Technology (VS), waar werd aangetoond dat CRISPR-Cas9 kon knippen op exacte plaatsen in het genoom van mensen- en muizencellen (Cong et al, 2013). Verder paste deze onderzoeksgroep Cas9 zo aan dat het DNA op een net iets andere manier knipte, waardoor een specifiek DNA-reparatiemechanisme in cellen werd gestimuleerd. Zo slaagden de onderzoekers erin een nieuwe DNA-sequentie precies op de geknipte locatie in te voegen ter vervanging van de originele sequentie (figuur 2).
Door dit pionierswerk veranderde CRISPR-Cas9 van een specialistisch microbiologisch onderzoeksobject in een spannende onderzoekstechniek waarmee wetenschappers zeer specifiek en eenvoudig genen kunnen aanpassen voor verschillende doeleinden.
Waar dient CRISPR-Cas9 voor?
Om het functioneren van genen te onderzoeken proberen wetenschappers vaak cellijnen of modelorganismen te maken waarin het te onderzoeken gen is gemuteerd of geïnactiveerd (een techniek die bekendstaat als gen-knockout). CRISPR-Cas9 biedt hiervoor een snelle en precieze manier. Verder kan het Cas9-enzym zo gewijzigd worden dat het niet langer DNA kan knippen maar nog steeds specifieke DNA-sequenties kan vinden om daaraan te binden, met dank aan het guide-RNA. Het gevolg hiervan is dat er geen plaats meer is voor de binding van RNA-polymerase. Zo kunnen wetenschappers de gentranscriptie controleren, het beginpunt van genactiviteit.
Dit zijn belangrijke technieken voor het biomedische onderzoek, maar CRISPR-Cas9 is ook veelbelovend voor directere toepassingen in de gezondheidszorg. Onderzoekers hebben gen-editing met CRISPR-Cas9 al gebruikt om HIV-sequenties uit te knippen en zo te voorkomen dat het virus zich kan voortplanten in menselijke cellijnen. De techniek is ook gebruikt om gemuteerde sequenties te verwijderen bij muizen met de ziekte van Duchenne, die leidt tot spierzwakte. Dit biedt dus hoop op een behandeling voor patiënten en families met deze en soortgelijke erfelijke aandoeningen. Onlangs is uitgebreide gen-editing met CRISPR-Cas9 uitgevoerd bij varkensembryo’s, om te proberen veiligere organen voor transplantatie bij mensen beschikbaar te maken.
Als dit bij varkensembryo’s is gebeurd, kan gen-editing dan ook worden uitgevoerd bij menselijke embryo’s? Dat is precies wat Chinese onderzoekers hebben gedaan in 2015, toen ze CRISPR-Cas9 hebben gebruikt om het β-thalassemie-gen bij 86 menselijke embryo’s te wijzigen (Cyranoski & Reardon, 2015). De techniek bleek tamelijk inefficiënt, aangezien de DNA-sequentie in minder dan een kwart van de embryo’s succesvol was gewijzigd. Toch leidde het nieuws over dit resultaat tot veel controverse vanwege de ethische implicaties.
Ethische vragen en de toekomst
De zorgen op ethisch gebied hebben niet alleen te maken met experimenten op menselijke embryo’s. Ook het ongemakkelijke vooruitzicht van gen-editing in geslachtscellen roept vragen op. Met CRISPR-Cas9 is het theoretisch mogelijk om het erfelijk materiaal van geslachtscellen (sperma en eicellen) te veranderen. Zulke veranderingen kunnen worden doorgegeven aan toekomstige generaties. Dit idee biedt enorme mogelijkheden voor het uitroeien van erfelijke ziektes, maar het roept ook de vraag op welke veranderingen in de toekomst mogen worden toegestaan als medische behandeling. Kunnen bijv. intelligentie of oogkleur beschouwd worden als geschikte eigenschappen om medisch te verbeteren? Mag deze angst dan vergezocht lijken, er is nog een andere zorg: dat gen-editing in geslachtscellen totaal onvoorziene en onomkeerbare effecten zou kunnen hebben op toekomstige generaties. Dit is uiterst relevant aangezien onlangs uit genetisch onderzoek is gebleken dat interacties tussen genen en andere erfelijke mechanismen veel complexer zijn dan van tevoren werd gedacht.
Deze implicaties zijn niet ontsnapt aan de aandacht van de wetenschap. Sommige onderzoekers zijn het erover eens dat we ons met het aanpassen van geslachtscellen begeven op ethisch uiterst glad ijs. Zij vinden dat elk CRISPR-Cas9-onderzoek met menselijke embryo’s moet worden stopgezet. Anderen menen echter dat een volledig moratorium niet alleen moeilijk te handhaven zou zijn, maar ook de voortgang van het onderzoek zou belemmeren. Ondanks zulke verschillende standpunten lijkt de wetenschappelijke gemeenschap gekozen te hebben voor dialoog en transparantie als de te volgen koers, wat blijkt uit de vele wereldwijd georganiseerde topconferenties en bijeenkomsten over dit onderwerp.
In de tussentijd volgen de ontwikkelingen op het gebied van CRISPR-Cas9 elkaar in hoog tempo op. Farmaceutische bedrijven investeren in de technologie ter ondersteuning van het onderzoek voor de ontwikkeling van geneesmiddelen. Technische onvolkomenheden worden aangepakt en verbeterd. Er is ondertussen een felle strijd gaande over het octrooi tussen de pioniers van de techniek (Doudna/Charpentier en Zhang). Ongeacht de uitkomst daarvan is de gigantische opkomst van CRISPR–Cas9 nog maar net begonnen.
References
- Cong L et al. (2013) Multiplex genome engineering using CRISPR/Cas systems. Science 339: 819–23. doi: 10.1126/science.123
- Cyranoski D, Reardon S (2015) Chinese scientists genetically modify human embryos. Nature 22 April, doi:10.1038/nature.2015.17378
Resources
- Lees verder over mogelijke toepassingen van CRISPR bij RNA-gen-editing.
- Lees verder over het octrooigeschil rond de CRISPR-Cas9-technologie.
- Leer hoe de CRISPR-Cas9-technologie gebruikt wordt voor de behandeling van de ziekte van Duchenne.
- Lees hoe CRISPR-Cas9 wordt toegepast bij de productie van varkensorganen voor transplantatie bij mensen.
- Lees een toegankelijk artikel over de ethische vragen rond gen-editing in geslachtscellen.
- Zie ook het volgende artikel met commentaar van internationale genetische onderzoekers over ethische vragen rond gen-editing in geslachtscellen:
- Bosley K et al. (2015) CRISPR germline engineering – the community speaks. Nature Biotechnology 33: 478–86
- Lees meer over de door Emmanuelle Charpentier ontwikkelde revolutionaire gen-editing-techniek, en luister hoe ze haar werk bespreekt.
Review
CRISPR-Cas9 is een krachtig ‘gps-achtig’ gereedschap voor gen-editing met vele mogelijke wetenschappelijke, medische en landbouwkundige toepassingen. De relatieve eenvoud en lage kosten van de techniek leiden tot belangrijke ethische vragen, en heeft ook geleid tot een opzienbarende rechtszaak tussen onderzoekers over de waardevolle octrooirechten.
Het artikel beschrijft duidelijk hoe palindromische herhalingen als basaal afweersysteem bij bacteriën zijn geïdentificeerd voor de toepassing van het programmeerbare CRISPR-Cas9-gereedschap voor gen-editing. Het artikel kan samen met animaties worden gebruikt om uit te leggen hoe de betrokken moleculairbiologische technieken werken en waarom CRISPR-Cas9 eerdere gen-editingmethodes heeft vervangen. Het kan ook de basis vormen voor discussies over ethische vragen rond gen-editing in geslachtscellen en rond intellectueel eigendom. Hier volgen enkele vragen om te controleren of de leerlingen het artikel hebben begrepen:
- Waar staat de afkorting CRISPR voor?
- Hoe werkt CRISPR-Cas9?
- Wat voor soort ziektes kunnen worden behandeld met CRISPR-Cas9?
- Wat zijn de mogelijke risico’s van het gebruik van CRISPR-Cas9?
- Welke ethische vragen zijn verbonden aan het gebruik van CRISPR-Cas9?
- Aan wie zou de Nobelprijs voor de ontdekking van CRISPR-Cas9 moeten worden toegekend?
Mary Brenan, Concord College, UK





