Lyuk az égen Understand article
Fordította: Adorjánné Farkas Magdolna. Huszonöt évvel ezelőtt az ózonlyuk felfedezése megrázta a sajtót. Tim Harrison és Dudley Shallcross elemzi az azóta kialakult helyzet.
A lyuk felfedezése
Flight Center Scientific
Visualization Studio szíves
hozzájárulásával közöljük
Ez egy meglepő felfedezés volt, emlékezik vissza Jonathan Shanklin, a lyuk egyik felfedezője: 1977-ben csatlakozott a British Antarctic Surveyw1 (Brit Antarktisz-kutatáshoz). Az volt a feladata, hogy digitalizálja az addig kézírással rögzített ózonmérési adatokat. Történetesen, az általa feldolgozott időszak tartalmazta az 1970-es éveket, amikor elkezdett csökkenni az ózonszint.
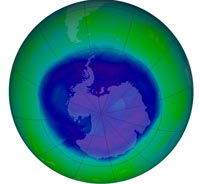
keletkezett ózonlyuk 2008
szeptember 12-én, amikor a
vastagsága elérte az évi
minimumát és 27 millió
négyzetkilométerre terjedt ki.
A NASA szerint ez aránylag
még nem is volt egy nagyon
nagy ózonlyuk
A képet a NASA szíves
hozzájárulásával közöljük
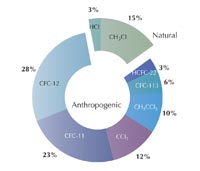
Akkor már felmerült annak a gyanúja, hogy az iparban használt klorofluorokarbonátok (CFC gázok) – szerves vegyületek, például a triklorofluorometán (CFCl3) és a diklorodifluorometán (CF2Cl2), amelyeket széles körben használnak a hűtőszekrényekben, hajtógázként a szóróflakonokban és oldószerként – tönkretehetik az ózonréteget. Shanklin 1983-ban egy előadásra készített egy grafikont – ironikusan annak a bemutatására, hogy az év ózonadatai nem térnek el a 20 évvel azelőttiektől. Ez igaz is volt az átlagos értékekre, azonban feltűnt neki, hogy a tavasszal mért értékek évről évre csökkenő tendenciát mutatnak. A további kutatások megerősítették ezt a felfedezést, és 1985-ben Shanklin és munkatársai, Joe Farman és Brian Gardiner publikálták a felfedezésüket: a déli félgömbön az Antarktisz fölött minden tavasszal lyuk keletkezik az ózonrétegben, amely egyre nő, és ezt valószinűleg a CFC gázok okozzák (Farman et al., 1985).
Mi a folyamat kémiai magyarázata, és miért veszélyes az ózonlyuk?
Ózon a sztratoszférában
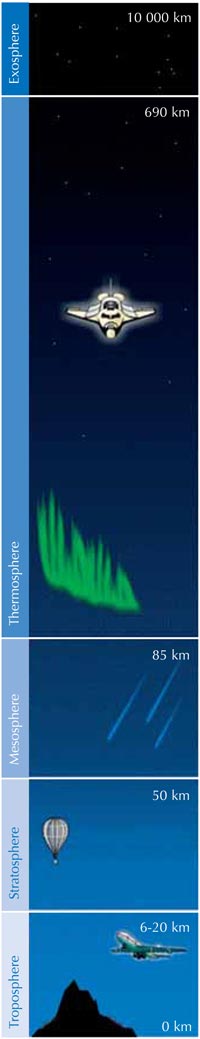
Az ózon (O3) az oxigén 3 atomos megjelenési formája, amely kevésbé stabil, mint a kétatomos (O2). Ez egy halványkék színű gáz, amely kis koncentrációban jelen van az atmoszférában – kétélű fegyver: a troposzférában (ld. később), jelenlévő ózon szennyeződésnek számít, amely károsítja az emberek és egyes állatok légzőrendszerét és égési sérüléseket okoz az érzékeny növényeken. A sztratoszféréban jelenlévő ózon azonban hasznos, mivel megakadályozza, hogy a Napból érkező ultraibolya (UV) sugárzás eléje a Föld felszínét.
Főként a sztratoszférában, a Föld felszínétől távolodva az atmoszféra második rétegében (körülbelül 10-50 km magasságban ld. az ábrát), a következő fotokémiai folyamat során képződik ózon:
O2 + hν → O• + O• λ ~ 200 nm (1)
O• + O2 + M → O3 + M (2)
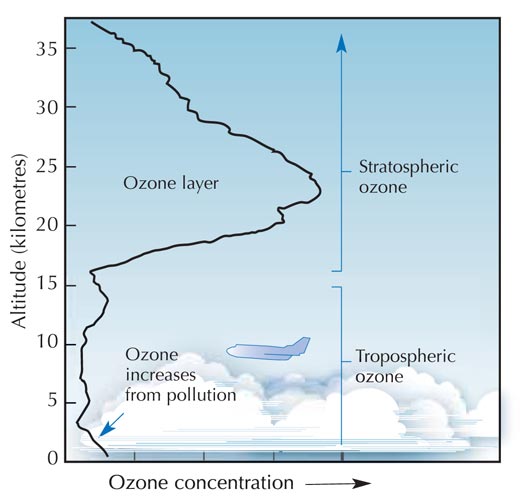
Szabadon felhasználható kép. A kép forrása: Wikimedia Commons
Egy oxigénmolekula (O2) az UV fényből elnyel egy fotont (hν), amelynek a hullámhossza (λ) körülbelül 200 nm, és két oxigénatomra bomlik (O•) (1. reakció). Azután mindkét oxigénatom hozzákapcsolódik egy-egy oxigénmolekulához, és így ózonmolekulák keletkeznek. Ha elegendően nagy a nyomás (M), (körülbelül egy-ezred atmoszféra, 100 Pa), akkor stabil marad az ózonmolekula. (2. reakció). Minél nagyobb a tengerszint feletti magasság, annál gyorsabban történik az 1. reakció (a Földfelszínhez 20 km-nél közelebb egyáltalán nem jutnak el a 200 nm-es fotonok, ugyanis elnyelődnek az 1. reakció során.) Azonban a 2. reakció gyorsabban megy végbe a felszínhez közel, mert ott nagyobb a légköri nyomás. A két reakció eredményeként a legtöbb ózon a 25 – 30 km-es magasságban van (ld.: a grafikont).
A sztratoszféra két ok miatt is fontos szerepet tölt be a földi élet szempontjából. Egyrészt, az ózon 250 nm hullámhosszúságú nagyenergiájú UV sugárzást nyel el (3. reakció).
O3 + hν → O• + O2 λ ~ 250 nm ΔH = – 90 kJ mol-1 (3)
A légkörben az oxigén (1. reakció) és az ózon (3. reakció) elnyeli a 200 és 300 nm közötti rövidhullámú UV sugárzás nagy részét, amely különben nagy mértékben károsítaná a földi életet.
Másrészt, a 3. reakció sok hőt termel, így a sztratoszféra melegebb, mint a troposzféra felső része (ld. a baloldali képet), így a troposzféra időjárása kevésbé szélsőséges, mint amilyen enélkül lenne.
A 2. és a 3. reakció során az oxigénatomok és az ózonmolekulák között gyors átalakulás zajlik le.Végbemegy azonban még egy lassú reakció is az oxigénatom és az ózonmolekula között, a következő módon:
O• + O3 → O2 + O2 (4)
Az 1-4. folyamatok összegzése az alábbi diagrammon látható:
A képet Marlene Rau szíves hozzájárulásával közöljük
Természetes körfolyamatok, amelyek csökkentik az ózonszintet
Paul Crutzen, Mario Molina és F Sherwood Rowland 1995-ben kémiai Nobel díjat kaptak azért a munkájukért, amellyel feltárták az ózon keletkezésének és felbomlásának folyamatát a sztratoszférában. Mire jöttek rá? 1970-ben Crutzen és mások felfedezték, hogy léteznek olyan természetes anyagok, amelyek katalizátorként működve felgyorsítják a 4. reakciót és ezzel csökkentik az ózon mennyiségét a sztratoszférában (Crutzen, 1970, 1971): víz (H2O), metán (CH4), dinitrogén-oxid (N2O) és klórmetán (CH3Cl) jut a légkörbe a Föld felszínén lezajló biológiai folyamatok következményeként, és ezekből a vegyületekből szabad gyökök keletkeznek, mint hidroxil (OH•), nitrogén-oxid (NO•) és klorid (Cl•), amelyek katalizálják az ózon lebomlásának folyamatát.

A képet Marlene Rau szíves hozzájárulásával közöljük
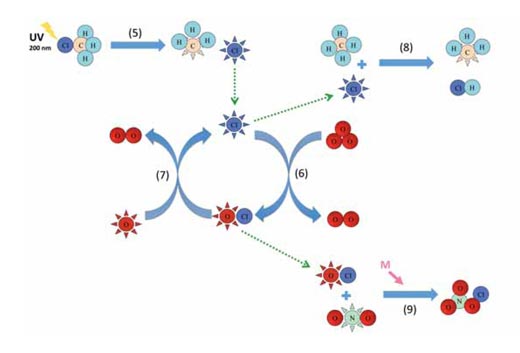
Az 5. reakció megmutatja, hogy a klórmetánból fotolízis során klóratom kerül a sztratoszférába, a 6. és 7. reakció pedig példa a katalitikus körfolyamatokra (ld. a fenti ábrát). Más katalizátorok közreműködése hasonló a 6. és 7. reakcióhoz. Klórmetánt tengeri és szárazföldi élőlények, mint például a vörös makroalga, a fehér gyökér gomba és a magasabb rendű növények egyaránt kibocsátanak annak a folyamatnak a során, amely szabályozza a sejtek kloridion szintjét. A klórmetán 30 – 40 év alatt eljut a sztratoszféra felső részébe (kb. 40 km magasságba), ahol a napfény hatására elbomlik (fotolízis):
CH3Cl + hν → •CH3 + Cl• l ~ 200 nm (5)
Az így keletkező szabad klóratom (Cl•) azután katalitikus körfolyamatokban vesz részt:
Cl• + O3 → ClO• + O2 (6)
ClO• + O• → Cl• + O2 (7)
A 6. és 7. reakció együtt megfelel a 4. reakciónak, de lényegesen gyorsabban megy végbe, mivel a klór/ klór-monoxid (ClO•) gyökök által katalizált reakció körülbelül 30000-szer gyorsabb. Akkor miért nem bomlik le az összes ózon ezekben a katalitikus körfolyamatokban? A válasz azokban a reakciókban rejlik, amelyek stabil molekulák képződése által megszakítják a körfolyamatokat:
Cl• + CH4 → •CH3 + HCl (8)
ClO• + •NO2 + M → ClONO2 + M (9)
Végül, a szabad klóratom összetalálkozik egy metánmolekulával és a reakció során hidrogén-klorid (HCl, 8. reakció) képződik. Hasonlóan, a klór-monoxid gyök összekapcsolódik a nitrogén-dioxid gyökkel és klór-nitrát jön létre (ClONO2, 9. reakció) – mivel ez is nyomás-függő reakció, ezért kis magasságban könnyebben végbemegy. A hidrogén-klorid és a klór-nitrát egyaránt nagyon stabil, és a szabad klóratom és a klór-monoxid gyök kilépése a rendszerből végül megszakítja a katalitikus körfolyamatot.
Az antarktiszi ózonlyuk rejtélye
forrásai a WMO / UNEP
Scientific Assessment of
Ozone Depletion alapján:
1998. A nagyobb méretű
változatért kattintson a
képre.
A képet Andrew Ryzhkov szíves
hozzájárulásával közöljük. A
kép forrása: Wikimedia
Commons
Nemrégen jöttek rá a tudósok arra, hogy a CFC gázok hasonlóan katalizálják az ózonlebontó folyamatokat: 1974-ben Molina és Rowland nemcsak arra figyelmeztettek, hogy szabályozás nélkül a CFC gázok mennyisége folyamatosan nő a légkörben, hanem azt is megjósolták, hogy a CFC gázok érzékelhetően hozzájárulnak az ózon csökkenéséhez a 40 km-es magasságban (ld.: Molina & Rowland, 1974). Mégis, amikor végül 1985-ben megtalálták az ózonlyukat, azt tavasszal a Déli-sark fölött 20 km-es magasságban észlelték (ld.: Farman et al., 1985).
Hamar kiderült a CFC gázokból felszabaduló klóratomok felelőssége, azonban sok kérdés maradt megválaszolatlanul. Miért a sarkpont fölött történik? Ha végbemegy a Déli-sark fölött, miért nem történik meg az Északi-sark fölött? Miért tavasszal történik? És az ózonlyuk miért 20 km magasságban keletkezik, az előrejelzett 40 km magasság helyett? Ennek az az oka, hogy a CFC vegyületek nem bomolhatnak el 20 km magasságban a napfény hatására, mivel a Föld-felszínhez ilyen közel ehhez már nem megfelelő a fotonsűrűség. Ezért nem keletkezik elegendő számú oxigénatom ahhoz, hogy végbemenjen a 7. reakció. Több évig tartó kutatás tárta fel a teljes történetet.

A képet Dudley Shallcross, Tim Harrison, Marlene Rau and Nicola Graf szíves hozzájárulásával közöljük
Először a CFC vegyületekből szabad klóratom szabadul fel, például:
CFCl3 + hν → •CFCl2 + Cl• l ~ 200 nm (10)
azután a klóratom reakcióba léphet a metánnal (8. reakció), és hidrogén-klorid keletkezik, vagy az ózonnal (6. reakció), és klór-monoxid gyök képződik, amiből a 9. reakció során klór-nitrát keletkezhet. Ez a reakciósorozat globálisan növelheti a sósav és a klór-nitrát koncentrációját a 40 km-es magasságban.
felé haladva
Szabadon felhasználható kép.
A kép forrása: Wikimedia
Commons
Amikor tél van a déli félgömbön, a Déli-sark körülbelül 3 hónapra sötétségbe borul. A Déli-sark fölött a sztratoszférában a levegő lehűl; az UV sugárzás nélkül a 3. reakció nem megy végbe, így nem keletkezik hő. A levegő lesüllyed, és mivel a Föld forgása következtében körbe áramlik, örvény keletkezik, akár a mosdókagylóból lefolyó víz esetében. Ez az örvény annyira stabil, hogy levegő se bejutni, se kijutni nem tud. Ezért a sósavban és klór-nitrátban gazdag levegő a 40 km-es magasságból lesüllyed ebben a hideg és sötét örvényben.
A szélsőségesen hideg sarki télben az örvényben lesüllyedő levegő -78°C (195 K) hőmérséklet alá hűl, és 15-25 km magasságban poláris sztratoszféra-felhő képződik a víz vagy a sósav kristályaiból.
Az első kémiai érdekesség, hogy a hidrogén-klorid és a klór-nitrát megkötődik a poláris sztratoszféra felhő felszínén és egy gyors heterogén reakció során légnemű anyagból szilárddá alakul, salétromsav (HNO3) keletkezik, amely beépül a jégkristályba, míg a klórgáz (Cl2) visszakerül a gáz fázisba.
HCl + ClONO2 → HNO3 + Cl2 poláris sztratoszféra felhő (11)
Ez a folyamat télen mehet végbe, amikor elég hideg van ahhoz, hogy kialakuljanak a poláris sztratoszféra felhők. Amikor tavasszal újra kisüt a nap, akkor 15-25 km-es magasságban már sok klórmolekula van, amelyekből fotolízis során szabad klóratomok keletkeznek:
Cl2 + hν → Cl• + Cl• l ~ 350 nm (12)
és azután a 6. folyamat során klór-monoxid gyökök.
Azonban a poláris tél idején a 7. reakció (a klóratomok és oxigénmolekulák képződése klór-monoxid gyökből és oxigénatomból) nagyon lassan megy végbe, mivel kevés oxigénatom van jelen. Ennek az az oka, hogy ebben a magasságban már nincsenek jelen a 200 nm-es fotonok. Egy másik különleges kémiai folyamat azonban megtörténik. Nagyon alacsony hőmérsékleten, amilyen a pólusnál kialakult örvényben még tavasszal is uralkodik, a klór-monoxid gyökökből klór-peroxid (ClOOCl) képződik:
ClO• + ClO• → ClOOCl (13)
Ez a vegyület szobahőmérsékleten nem stabil, azonban könnyen létrejön alacsony hőmérsékleten (-30 °C alatt), és utána fotolízis során elbomlik:
ClOOCl + hν → Cl• + O2 + Cl• l ~ 300 nm (14)
Így, bár a 7. reakció nem mehet végbe, azonban a 14. reakció során mégis keletkeznek szabad klóratomok a 300 nm hullámhosszúságú fény segítségével, és az ózon lebomlásának körfolyamata azonnal elindul, ahogy megjelenik a napfény.
Hogyan különbözik ez a folyamat az előbbiekben megvizsgált katalitikus körfolyamattól – miért bomlik el az örvényben bizonyos magasságban minden ózon? Egyrészt, a 8. reakció (amelynek során megkötődnek a szabad klóratomok és ezzel megszakad a körfolyamat) nagyon lassú és ezért hatástalan az örvényben uralkodó alacsony hőmérsékleten. Másrészt, a nitrogén-dioxid, amely szükséges a 9. folyamathoz (amely szintén megszakítja a körfolyamatot a ClONO2) létrejötte miatt), a téli viszonyok között salétromsavvá alakul (pl. a 9. és a 11. reakció során), és a visszaalakulásra nincs lehetőség, mivel az örvényben nincs felfelé áramlás (az örvény aljánál a levegő a Déli-pólustól az Egyenlítő felé áramlik, ahol megtörténik a felfelé áramlás). Ezért a folyamat ezen a szinten megsemmisíti az egész ózonréteget. Végül, az ózon nélkül nem mehet végbe a hőtermelő 3. reakció, ezért az örvény még tavasszal is sokáig megmarad, erősítve az ózonpusztulást.

norvégiai Askerben
Szabadon felhasználható kép.
A kép forrása: Wikimedia
Commons
Az egyetlen ok, amiért az ózonlebomlás komolyabb a Déli-pólus felett, mint az Északi-pólus felett az, hogy tavasszal az utóbbi felett egy kicsivel magasabb a sztratoszféra hőmérséklete, annak köszönhetően, hogy az északi féltekén a középső és a nagy földrajzi szélességeknél több hegység található, és ezek megváltoztatják az atmoszférában végbemenő áramlások dinamikáját, így kevesebb poláris sztratoszféra felhő képződik.
Késő tavasszal ózondús levegő áramlik be az örvénybe, így végbemehet a 3. reakció, amely felmelegíti a levegőt és ezáltal megszűnik az örvény. Így lehetővé válik az atmoszférában a gázok keveredése és ózon áramlik be a környező levegőből az ózonlyukba.
Néhány év alatt az Antarktisz feletti ózonlyuk olyan nagy kiterjedésű lett, hogy elérte Ausztráliát, Új-Zélandot, Chilét és Argentinát, a mérete másfélszer nagyobb volt az USA területénél. Amikor megszűnik az ózonlyuk, ózonmentes levegő áramlik a környező (lakott) területek, többek között Dél-Afrika fölé. Az itt élő emberek egészségét az ózonlyuk közvetlenül veszélyezteti. A fő gondot az jelenti, hogy megnő az UV sugárzás, amely bőrrákot, szürkehályogot idézhet elő és az immunrendszer gyöngülését okozhatja. Az erős UV sugárzás a növényzetet és az egyes építőanyagokat is károsíthatja.
A CFC gázok és az ózon ma
Ma már jól értjük az ózon létrejöttének és lebomlásának fizikáját és kémiáját.
Amint nyilvánvalóvá vált, hogy a CFC gázoknak szerepe van az ózon lebomlásában, Montreálban 1987-ben kormányszintű megállapodás született a CFC gázok használatának betiltásáról, és arról, hogy fokozatosan rövidebb élettartamú vegyületekkel (hidrofluorkarbonokkal és hidrokloro-fluorokarbonokkal) helyettesítik. A Montreali Egyezményt további kiegészítések erősítették meg 1990-ben és 1992-ben, amelyek felgyorsították a CFC gázok használatból kivonásának folyamatát. Ezt környezetvédelmi sikerként lehet elkönyvelni.
Az AGAGE (Advanced Global Atmospheric Gases Experiment)w2, 1978 óta figyelemmel kíséri a CFC gázok és helyettesítőik szintjét: a mérési adatok azt mutatják, hogy a dikloro-difluorometánnak (CF2Cl2), a leghosszabb életű CFC-nek a mennyisége csökken: a szabályozás tehát hatásos (bal oldali ábra). Bár most is minden tavasszal keletkezik egy ózonlyuk a Déli-pólus felett, de a becslések szerint 2050-től már ez nem fog megtörténni, és 2080-ra a globális ózonszint újra eléri az 1950-es évekre jellemző értéket.
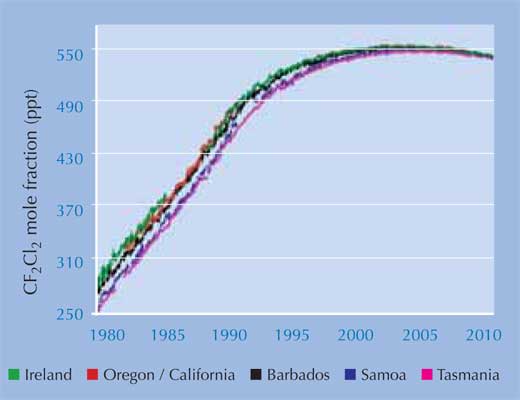
A képet az AGAGE projekt szíves hozzájárulásával közöljük.
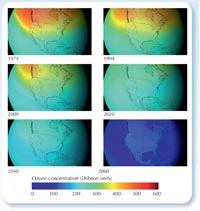
ózon mennyisége, ha nem
tiltották volna be a CFC-ket.
A nagyobb méretű
változatért kattintson a képre
A NASA képet a Goddard Space
Flight Center Scientific
Visualization Studio szíves
hozzájárulásával közöljük
Az ózonlyuk kialakulása az növekvő CFC felhasználás rovására írható, amely az 1930-as években kezdődött. A CFC-k, akár más gázok, 30-40 év alatt érik el a sztratoszféra felső rétegét, emiatt az ózonrétegre gyakorolt hatásuk késleltetve jelenik meg. Most okoz a sztratoszférában kiugró klórkoncentráció-növekedést az, hogy az 1980-as években nagy mennyiségű CFC-t használtunk – így majd csak néhány év múlva számíthatunk arra, hogy csökken az évente megjelenő ózonlyuk mérete.
Bár lassan épül fel újra az eredeti ózonréteg, a katasztrófát sikerült megelőznünk: a tudósok kiszámították, hogyha továbbra is ugyanúgy évente 3 %-kal növekedett volna a CFC felhasználás, mint az 1970-es években, 2060-ra az ózonlyuk globális méretet öltene, és ez súlyos egészségi következményekkel járna. (Ld.: 53. oldal; Newman et al., 2009).
Az ózonlyuk alakulásából levonható legfontosabb következtetés az, hogy a bolygónkat nagyon gyorsan megváltoztathatja az emberi tevékenység – különösen rossz, de akár jó irányban is – és ha koncentráltan, hatásosan és gyorsan cselekszünk, jó irányban befolyásolhatjuk a változásokat.
References
- Crutzen PJ (1970) Influence of nitrogen oxides on atmospheric ozone content.Quarterly Journal of the Royal Meteorological Society 96: 320-325. doi:10.1002/qj.49709640815
- Crutzen PJ (1971) Ozone production rates in an oxygen-hydrogen-nitrogen oxide atmosphere. Journal of Geophysical Research 76(30): 7311-7327. doi:10.1029/JC076i030p07311
- Farman JC, Gardner BG, Shanklin JD (1985) Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction. Nature 315: 207-210. doi:10.1038/315207a0
-
A cikk szabadon hozzáférhető a Nature weboldalán (www.nature.com) vagy a következő linken: http://tinyurl.com/2wemxhn
-
- Molina MJ, Rowland FS (1974) Stratospheric sink for chlorofluoromethanes – chlorine atomic-catalysed destruction of ozone. Nature 249: 810-812. doi:10.1038/249810a0
-
A cikk szabadon hozzáférhető a Nature weboldalán (www.nature.com) vagy a következő linken: http://tinyurl.com/2u69cul
-
- Newman PA et al. (2009) What would have happened to the ozone layer if chlorofluorocarbons (CFCs) had not been regulated? Atmospheric Chemistry and Physics 9: 2113-2118. doi: 10.5194/acp-9-2113-2009
- Patterson L (2010) A chemical bond: Nick Barker, linking schools and universities in the UK. Science in School 15.
- Veneu-Lumb F, Costa M (2010) Hogyan használjunk fel újsághíreket a természettudomány órákon? Science in School 15: 30-33.
Web References
- w1 –A Brit Antarktisz-kutatás felelős a UK nemzeti tudományos tevékenységéért az Antartktiszon. Ld.: www.antarctica.ac.uk
- w2 – Az Advanced Global Atmospheric Gases Experiment, AGAGE, egy NASA-által támogatott kezdeményezés, amely 1978 óta folyamatosan méri a földi atmoszféra összetételét, beleértve a CFC gázokat és a CO2 kivételével a legtöbb üvegházhatású gázt, amelyekre a Kiotói egyezmény vonatkozik. Az adataikért és további információkért ld.: http://agage.eas.gatech.edu
Resources
- Sidney Chapman fedezte fel azt a fotokémiai mechanizmust, amelynek során az ózon keletkezik és elbomlik. Ld.:
-
Chapman S (1930) On ozone and atomic oxygen in the upper atmosphere.Philosophical Magazine Series 7 10(64): 369-383. doi:10.1080/14786443009461588
-
- Jonathan Shanklin, aki egyike volt az ózonlyukat felfedező tudósoknak, 25 évvel a felfedezés után közzétette a gondolatait:
-
Shanklin J (2010) Reflections on the ozone hole. Nature 465: 34-35. doi: 10.1038/465034a
-
Töltse le innen, az ingyenes cikket, vagy fizessen elő még ma aNature-re: www.nature.com/subscribe
-
- A Nature–ben sok olyan cikk jelent meg, amelyekből többet megtudhatunk a sztratoszféráról és az ózonrétegről, a felfedezésének történetéről. Ezek egy része ingyen hozzáférhető. Ld.: www.nature.com/nature/focus/ozonehole
- A NASA’s Ozone Hole Watch (Ózonlyuk Figyelő) oldalakon régi ózon-térképeket, adatokat, az ózonnal kapcsolatos multimédia galériát, a tanításhoz felhasználható modulokat találhat. Ld.: http://ozonewatch.gsfc.nasa.gov
- A University of Cambridge, UK összeállított egy virtuális túrát az ózonlyuk körül, leírva a történetét és a tudományos ismereteket. Angol, francia és német nyelven érhető el. Ld.: www.atm.ch.cam.ac.uk/tour
- Az a 74 tudós, aki 2002-ben résztvett az ózonrétegről tartott értékelő találkozón a svájci Les Diablerets-ben, közzétett egy kiadványt 20 Questions and Answers about the Ozone Layer címmel, amely többek között a naptevékenység-változás és a vulkánktörések hatásával is foglalkozik. Ld.:www.gcrio.org vagy a következő linken: http://tinyurl.com/2wpvf9r
- A Harvard University professzorának, Daniel J Jacobnak az Introduction to Atmospheric Chemistry című műve szabadon hozzáférhető PDF formában, amelynek egyik fejezete az ózonról szól és tartalmazza a ‘Chronology of the ozone hole’ (Az ózonlyuk időbeli alakulása) ábrát (chapter 10.3.3). Ld.:http://acmg.seas.harvard.edu/people vagy a következő linken:http://tinyurl.com/39vhy6a
- Az Ozzy Ozone a United Nations Environment Programme (Egyesült Nemzetek Környezeti Programjának) weboldala, amely többek között az oktatásban használható képregényeket, játékokat és kifejezések magyarázatát kínálja fel. Innen szabadon letölthetők oktatócsomagok, tanulóknak és tanároknak szóló könyvekkel általános- és középiskolások számára egyaránt. Minden anyag elérhető angol, francia és spanyol nyelven. Ld.: www.ozzyozone.org
- A tudós és író Rod Jenkins Ozone Depletion weboldala naprakész információkat tartalmaz: www.ozonedepletion.info
- A United Nations Environment Programme (Egyesült Nemzetek Környezeti Programja) weboldalának OzonAction része sok adatot és információt közöl az ózonról és a Montreáli Egyezményről. Ld.: www.unep.fr/ozonaction
-
A United Nations Environment Programme Ozone secretariat oldalai angolul, franciául és spanyolul hozzáférhetők. Ld.:http://ozone.unep.org
-
- A NASA két online videót tett közzé a Déli-pólus feletti atmoszféra változásairól, az Upper Atmosphere Research Satellite (UARS) mérései alapján.
-
Meg lehet figyelni a klór-nitrát koncentrációjának növekedését 1993 február/ márciusban. Ld.: http://tinyurl.com/2w6wgh4
-
A video megmutatja a poláris sztratoszféra-felhő kialakulását. Ld.:www.nasaimages.org or use the direct link:http://tinyurl.com/33dfn6e
-
- Ráadásul a NASA képeket tesz közzé az ózonlyuk évszakonkénti változásáról. Ld.:www.nasa.gov/vision/earth/lookingatearth/25TOMSAGU.html
Review
Az ózonlyuk fontos globális probléma, és ez a cikk sokat segít a kérdés megismerésében. A téma szempontjából fontos kémiai folyamatokat részletesen ismerteti. A cikket felhasználhatják a kémia órákon, a molekulák szerkezetének, a kémiai kötéseknek, a szabad gyököknek és a katalitikus körfolyamatoknak a tanításánál, valamint akkor, amikor arról beszélnek, hogy a fény és a hőmérséklet milyen hatással van a kémiai folyamatokra.
A földtudomány témakörnél a következő részeknél lehet felhasználni a cikket:
- A légkör szerepe a klíma alakulásában.
- A Föld felszínén lezajló folyamatok, amelyek hatással vannak a tengeri élőlényekre.
- A Föld morfológiája és a hegységek elhelyezkedése a Föld felszínén
- Az évszakok váltakozása, a Föld tengelyének ferdesége és a Föld forgása.
Lehetőséget ad arra, hogy interdiszciplináris munkát végezzenek, összekötve a kémiát és a földtudományt. A felhasználható témák:
- Azoknak az élőlényeknek az eloszlása a Földön, amelyek a természetes katalitikus folyamatokban szerepet játszó vegyületeket termelnek. Hol élnek ezek az élőlények? Milyen anyagokat termelnek?
- A légkör kémiai összetétele és hatása a klímára. Milyen gázokból áll a légkör? Hogyan határozzák meg a légkör tulajdonságai a Föld-felszín klímájának alakulását, és miben különbözik ez a többi bolygóétól?
A cikk kiindulási alapot jelenthet egy olyan órán, amikor azt vizsgálják meg, hogy hogyan jelennek meg a természettudományos témák a médiában. A tanulók ezt a cikket összehasonlíthatják az általános médiában megjelentekkel: megvalósul-e a kérdések közötti egyensúly: egyforma hangsúllyal említik-e a cikkek azokat a mesterséges és természetes vegyületeket, amelyek az ózonlyuk kialakulásához vezetnek? Kisebbítik-e vagy túlhangsúlyozzák-e az ózonlyuk jelentőségét? Ha igen, miért? Az újságírók tudatlansága miatt, politikai okból, vagy mindkettőnek szerepe van? További ötleteket meríthet az újságcikkek felhasználásáról a természettudományos órákon: Veneu-Lumb & Costa (2010).
Végül, a szöveg kiindulási alapot adhat egy fogalmazás megírásához. A lehetséges kérdések:
- Mi lehet az oka annak, hogy ma ez a leginkább vitatott kérdés?
- Mi a szerepe a természetes tényezőknek az ózonlyuk kialakulásában? Mi a helyzet az emberi tényezőkkel?
Teresa Celestino, Olaszország





