Les goûts à mâcher Teach article
Traduit par C. Pugieux. Ken Gadd et Luca Szalayp résentent une procédure utilisée dans l’industrie, adaptée ici pour les élèves, pour mesurer la teneur en acide citrique du chewing-gum.
Traduit par C. Pugieux

Combien de personnes connaissez-vous qui mâchent du chewing-gum? Pourquoi le font-ils? Vous pourriez essayer de deviner, mais la réponse la plus probable sera certainement pour le goût. Le chewing-gum consiste en une base de gomme non soluble dans l’eau et des ingrédients solubles dans l’eau tels que les arômes et les édulcorants. Lorsque vous mâcher un chewing-gum, les arômes et les édulcorants sont libérés, dissous et avalés (en espérant que le chewing-gum reste dans la bouche). Une fois les arômes extraits, la gomme est jetée. Malheureusement elle adhère fortement aux surfaces solides telles que le macadam et est très difficile à enlever.
Il y a de nombreuses preuves de cela si vous regardez les pavés sur lesquels vous marcher. Mais retournons au goût.
Un des ingrédients classiques du chewing-gum et des bonbons est l’acide citrique. Il donne ce goût fort, frais de citron qui ‘attaque’ la langue. La teneur en acide citrique est écrite sur l’emballage. C’est le travail du chimiste analytique du laboratoire de Control de qualité de le déterminer. La méthode décrite ci-dessous est basée sur les procédés standard utilisés par le fabriquant de diverses arômes de chewing-gum et de buble-gum (un type de chewing-gum). Ce protocole a été adapté pour son utilisation au sein des écoles et collèges de manière à ce que vos étudiants puissent mimer d’authentiques pratiques de laboratoire.
Voilà quelques questions que vous pourriez utiliser pour que les élèves se posent des questions:
- Combien de personnes connaissez-vous qui mâchent du chewing-gum?
- Quel âge ont-ils?
- Qu’est-ce qui rend le bubble-gum différent des autres types de chewing-gum?
- Comment peut-on enlever du chewing-gum collé sur un vêtement?
- Pourquoi les chewing-gums sans sucre ont-ils quand même un goût sucré?
- Comment déterminez-vous la teneur en acide d’un chewing-gum?
Le projet StandardBase
Le projet StandardBase a produit 72 procédures analytiques standard, utilisées dans l’industrie et adaptées pour leur utilisation par les élèves du collège et du lycée, disponibles sur Internet. Pour de plus amples informations sur le projet, consulter “StandardBase: un projet pilote Leonard de Vinci pour l’éducation et les travaux pratiques en chimie” dans ce numéro de Science in School.
Protocole: Détermination de l’acide citrique dans le chewing-gum Hubba Bubba® par la méthode de titration acide-base
| Durée |
1 heure |
|---|---|
| Instruments d’analyse nécessaire | Instrument de mesure du volume en verre |
| Echantillon | Bubble-gum Hubba Bubba®goût orange |
| Fournisseurs |
La plupart des boulangeries et supermarchés |
| Composé à déterminer | Acide citrique |
| Méthode(s) |
Titration acide-base |
| Domaine | Agro-alimentaire |
Avant que les élèves ne commencent les travaux pratiques, les enseignants peuvent s’assurer des connaissances de leurs élèves en chimie analytique. Afin de vérifier que les élèves aient les connaissances suffisantes, ils pourraient faire le test interactif proposé sur le site internet StandardBasew1. Pour les aider dans leur travail, les élèves peuvent également télécharger un document sur la titrationw2.
Portée
Le but de la procédure analytique est de déterminer l’acide citrique contenu dans le bubble-gum Hubba Bubba®. Ce bubble-gum est en vente au Royaume-Unis et dans la plupart des pays européens. Il est fabriqué par Wrigleyw3 à Plymouth, au Royaume-Unis. La méthode décrite ici est basée sur la procédure analytique utilisée par Wrigley dans ses laboratoires d’analyses de Plymouth.
Principe
La détermination est basée sur la réaction acide-base entre l’acide citrique du bubble-gum et une solution étalon d’hydroxide de sodium. La teneur en acide citrique du bubble-gum peut etre calculée à partir des résultats de titration.
Equipment
- Rouleau à pâtisserie
- Flasque conique de 250 cm3
- Flasque graduée de 250 cm3
- Flasque graduée de 100 cm3
- Agitateur magnétique
- Burette de 10 cm3 burette (avec une précision de 0.02 cm3)
- Balance de précision
- Planche à decouper
- Couteau / paire de ciseaux
Materiels et leurs références CASw4
- Hubba Bubba® à l’orange
- Hydroxide de sodium (CAS number: 1310-73-2)
- Phénolphthaléine (CAS number: 77-09-8)
Solutions
- Solution standard d’hydroxide de sodium à 0.10 mol dm-3. S’il n’y en a pas de disponible, dissoudre 1.00g d’hydroxide de sodium dans environ 100 cm3 d’eau pure contenue dans une flasque graduée et complèter jusqu’à 250 cm3. Homogénéiser la solution. Standardiser par titration avec 0.10 mol dm-3d’acide hydrochlorique, lui-même standardisé avec de l’hydrocarbonate de potassium solide.
- Indicateur de phénolphthaléine. Peser 0.20g de phénolphthaléine et dissoudre dans environ 50 cm3 de méthanol. Transférer la solution dans une flasque graduée de 100 cm3, et compléter avec du méthanol jusqu’à la marque de graduation et homogénéiser la solution.
Protocole
- Prendre un Hubba Bubba®bubble-gum goût orange, le sortir de son emballage et le placer sur une planche à découper.
- Avec un rouleau à pâtisserie, étaler le bubble-gum jusqu’à obtenir un ruban très fin de taille approximative 160 x 30 x 0.5 mm.
- Détailler le ruban en petites morceaux de la taille de longs grains de riz.
- Peser environ 1.00g de ces morceaux de bubble-gum Hubba Bubba®.
- Ajouter ces morceaux dans 100 cm3 d’eau pure contenue dans une flasque conique de 250 cm3. Ajouter un agitateur magnétique.
- Agiter vigoureusement pendant 30 min, en prenant soin de vérifier que le bubble-gum ne s’agrège pas.
- Ajouter 0.50 cm3 d’indicateur de phénolphthaléine et titrer avec 0.10 mol dm-3 d’hydroxide de sodium contenu dans une burette de 10 cm3. La solution finale est rose.
- Répéter 2 fois et faire une moyenne des 3 résultats. La titration moyenne doit être exprimée en = V cm3.
Calculs
Utiliser ce qui suit pour calculer le pourcentage par poids de l’acide citrique monohydrate contenu dans le bubble-gum Hubba Bubba®:
- Chaque centimètre cube de 0.10 mol dm-3 d’hydroxide de sodium est équivalent à 7.0mg d’acide citrique monohydrate
- % par poids d’acide citrique monohydrate = 0.70V
Note: un facteur de correction est nécessaire si la solution d’hydroxide de sodium n’est pas exactement de 0.10 mol dm-3.
Résultats
Donner la masse d’acide citrique monohydrate dans le bubble-gum Hubba Bubba® en pourcentage par poids (masse d’acide citrique monohydrate dans 100g de bubble gum). Le fabriquant autorise une gamme de 1.9-2.1 pourcentage par poids.
Précision
La précision de l’analyse est déterminée par les lectures sur la burette. Un élève sans expérience lit en général avec une précision ± 0.05 cm3. Un élève plus expérimenté peut lire à ± 0.02 cm3.
The graph
La courbe ci-dessous montre les résultats obtenus par des étudiants européens (correcte au moment de l’impression). Si vos étudiants sont intéressés sur les données récentes, ils peuvent consulter les dernières mises-à-jour disponible en lignew5.
Si vos étudiants souhaitent ajouter leurs résultats à la courbe, contacter Luca Szalay (luca@chem.elte.hu). Vous recevrez un identifiant et un mot de passe qui vous permettront d’utiliser cette fonction de la base de données StandardBase. Ensuite vous pouvez enregistrer vos étudiants, ce qui leur permettra d’ajouter leurs données sur la courbe.
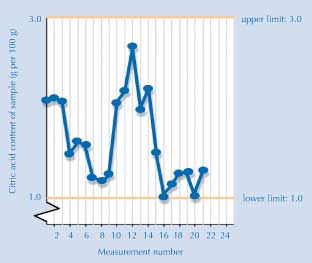
Image reproduite avec l’aimable autorisation de Luca Szalay
Web References
- w1 – Les enseignants peuvent suggérer à leurs élèves de faire le test interactif proposé sur le site Internet de StadardBase: www.vapro-ovp.com/applications/toetsing/vraag.asp?toetsID=29
- w2 – Un document portant sur la titration peut être téléchargé à partir du site Internet de StadardBase: www.standardbase.com/tech/uk-voltech.pdf
- w3 – Pour de plus amples informations sur les produits Hubba Bubba® visiter le site Internet www.wrigley.co.uk/index.cfm?articleid=138
- w4 – Le bureau officiel CAS est la plus ample et la plus actuelle base de données d’information sur les substances chimiques dans le monde. Voir le site Internet www.cas.org/expertise/cascontent/registry/regsys.html
- w5 – Une courbe présentant les résultats obtenus au cours de cette analyse peut être visualisée et téléchargée ici: http://standardbase.live.ism.nl/sbase/maindetails.asp?expid=3362#
Review
Cet article offre une approche intéressante et originale des réactions acide-base et de la titration acide-base, deux sujets généralement considérés comme ennuyeux (souvenez-vous lorsque vous étiez élève?)
A partir d’un objet familier (le chewing-gum), avec ses caractéristiques et ses problèmes pratiques, les auteurs présentent la procédure analytique (détermination de l’acide citrique contenu dans le chewing-gum Hubba Bubba®), en élargissant le sujet à des aspects théoriques incluant des références Internet. Les enseignants de chimie pourraient utiliser l’article pour discuter de l’importance des procédures standard analytiques, en plus du sujet des réactions acide-base et de la titration acide-base. L’analyse proposée donne l’opportunité d’un traitement mathématique et de partager les résultats obtenus, liant ainsi la chimie aux statistiques.
Le lien avec la réalité du travail au sein d’un laboratoire de contrôle qualité, la richesse du matériel didactique disponible sur le site de StandardBase (tests préliminaires, théorie, courbes et protocoles) rend ‘Les goûts à mâcher’ une ressource utile pour les enseignantsesseurs de chimie et les élèves. Il pourrait être utilisé pour discuter du rôle du chimiste analytique dans le contexte de l’industrie et de la recherche et/ou pour préparer la visite d’une usine ou d’un laboratoire.
Cet article peut être utilisé dans le cycle secondaire ou lors de travaux pratiques spécialisés. Il y a également d’autres procédures accessibles sur le site Internet de StandardBase. La possibilité de se joindre au projet représente un intérêt supplémentaire de l’article.
Les enseignants peuvent poser les questions suivantes :
La substance qui donne le goût orange au bubble-gum Hubba Bubba® est:
a) l’acide malique
b) l’acide citrique
c) l’acide ascorbique
d) l’acide hydrochlorique
La concentration de la solution étalon utilisée dans le protocole est:
a) 0.10 g dm-3
b) 1.00 % par poids
c) 0.10 mol dm-3
d) 1.00 mol dm-3
Suivant la recommandation des auteurs, je trouverais intéressant de mettre au point une technique chimique pour enlever du chewing-gum collés sur des surfaces ou sur des vêtements.
Giulia Realdon, Italie





