Un oeil neuf sur la lumière : fabriquez votre spectromètre Teach article
Traduit par Camille Ducoin. Prenez un CD et une boîte de céréales : qu'avez-vous? Votre propre spectromètre, avec l'aide de Mark Tiele Westra! Il est maintenant temps d'explorer les joies de la couleur, dissimulée dans les objets les plus ordinaires.
l’aimable autorisation du
National Optical Astronomy
Observatory / Association of
Universities for Research in
Astronomy/National Science
Foundation
La lumière blanche… n’est pas blanche : elle est constituée de beaucoup de couleurs différentes. La composition de la lumière (son spectre) s’étudie grâce à un appareil nommé spectromètre. Nous verrons dans cet article comment en construire un, rien qu’avec une boîte de céréales et un disque compact. Cet instrument fait-maison nous permettra d’admirer le monde merveilleux des couleurs cachées dans les objets environnants, comme les ampoules, les tubes fluorescents, les écrans d’ordinateurs et les flammes de bougies. Explorons!
Comment décomposer la lumière
Il y a plusieurs façons faire apparaître les couleurs composant la lumière blanche. On peut utiliser un prisme, comme le fit Newton : du fait de leurs différents indices de réfraction, les différentes couleurs suivent des chemins distinct à travers le prisme, et en sortent séparées.

compacte, grossie 6250 fois
Image reproduite avec
l’aimable autorisation de Mark
Tiele Westra
Une autre façon est d’utiliser une grille de diffraction formée d’un grand nombre de sillons minuscules tracés parallèlement les uns aux autres sur une surface, comme il est montré ci-dessous.
De par l’interaction des ondes de lumière avec les petits sillons, les différentes couleurs se trouvent réfléchies dans différentes directions.
Par chance, tout le monde possède des grilles de diffraction de haute qualité : les disques compactes (CDs). Les belles couleurs que l’on voit quand la lumière se reflète sur la surface d’un CD indiquent clairement que celle-ci agit comme une grille de diffraction. Mais pourquoi? L’illustration ci-dessus montre à quoi ressemble une surface de CD vue avec un fort grossissement. La musique est codée par des creux courts et longs, placés le long d’un long sillon en spiral à la surface du disque. Les sillons, séparés de 1.6 µm (1600 nm), forment la grille de diffraction.
Construire un spectromètre avec une boîte de céréales
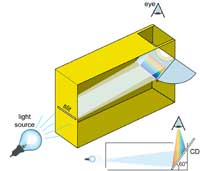
spectromètre avec une boîte
de céréales. Le CD fait un
angle de 60º avec le fond de
la boîte
Image reproduite avec
l’aimable autori sation de Mark
Tiele Westra
Nous pouvons faire bon usage de ces grilles de diffraction communes pour construire notre propre spectromètre. Pour cela il faut deux éléments importants : un CD, qui sépare la lumière en différentes couleurs, et une fente étroite de l’autre côté de la boîte, afin de produire un mince faisceau de lumière.
La fente est réalisée sur un côté de la boîte, en utilisant du papier épais et du ruban adhésif. Un modèle un peu plus sophistiqué peut être construit avec deux petites lames de rasoir jetable, en situant les deux bords tranchants l’un en face de l’autre, comme on le voit sur l’image. Si la fente est trop large, le spectre sera brouillé ; si elle est trop étroite, il sera trop sombre. Il semble que 0.2 mm soit un bon compromis, mais vous pouvez faire l’expérience. La qualité du spectre obtenu dépend beaucoup de la qualité de la fente : elle doit être réalisée avec soin.
De l’autre côté de la boîte, installez un CD en faisant un angle de 60º avec le fond de la boîte (l’auteur a utilisé un CD vierge). Au-dessus, pratiquez une ouverture à travers laquelle le CD peut être observé. Pour éviter que de la lumière parasite entre dans la boîte, couvrez tous les trous autour du CD, ainsi que les bords du CD, avec du ruban adhésif noir.
Pour observer un spectre, la fente est dirigée vers la source de lumière (le plus près possible), et l’observateur regarde à travers l’ouverture au-dessus du CD. Bougez un peu la boîte pour trouver la meilleure position. On peut photographier les spectres observés avec un simple appareil photo numérique en mode ‘macro’, attaché à la boîte avec du ruban adhésif ou des élastiques. Il vaut mieux disposer d’un réglage manuel, car il est plus difficile d’obtenir un spectre bien net avec l’auto-focus.
Observations

Image reproduite avec l’aimable autorisation de Mark Tiele Westra

Image reproduite avec l’aimable autorisation de Mark Tiele Westra
Il est temps de passer aux expériences ! Essayons d’abord de regarder le spectre d’une ampoule à incandescence ordinaire. Le résultat est montré ci-dessous.
Nous voyons un joli spectre continu, avec toutes les couleurs de l’arc-en-ciel. Dans une ampoule, la lumière est produite par un filament de métal très chaud.
Regardons ensuite deux tubes fluorescents différents, émettant tous deux de la lumière blanche.
Le premier, un tuble fluorescent ordinaire, présente plusieurs raies étroites par-dessus un fond continu. Ces raies d’émission (voir texte ci-dessous) sont produites par la vapeur de mercure à basse densité qui se trouve dans le tube. Le mercure produit aussi de la lumière ultraviolette, qui est transformée en un spectre continu de lumière visible par une fine couche de phosphore sur la face intérieure du tube.
Le second tube fluorescent présente un spectre très différent (voir ci-dessous). En effet, les fabriquants peuvent faire varier les différentes couleurs du tube en utilisant différentes combinaisons de phosphores. Dans le cas illustré ici, le phosphore émet un spectre continu, mais le tube contient ce qu’on appelle des phosphores à trois couleurs : une combinaison de trois phosphores ayant chacun son propre ensemble de raies d’émission. Nous percevons ce mélange de couleurs comme de la lumière blanche.
Nous montrons ensuite le spectre émis par un extrait d’écran d’ordinateur affichant un document Word blanc. Les trois couleurs des pixels qui composent l’image (rouge, vert et bleu) apparaissent distinctem.

Image reproduite avec l’aimable autorisation de Mark Tiele Westra

Image reproduite avec l’aimable autorisation de Mark Tiele Westra
Comment se forment les spectres
Certains des spectres pouvant être observés avec la boîte-spectromètre ont un fond continu, avec des couleurs variant peu à peu du rouge foncé au bleu foncé. D’autres présentent des raies bien marquées sur fond continu, ou des raies sans fond, ou encore des raies noires sur fond continu, comme le spectre solaire (voir ci-dessous). Pourquoi une telle diversité ? Comment les spectres se forment-ils ?

avec une flamme produit une
raie d’émission du sodium
Image reproduite avec
l’aimable autorisation de Mark
Tiele Westra
Tout cela est dû aux atomes. Un atome donné peut se trouver dans différents états d’énergie, selon que ses électrons occupent leurs orbites habituelles ou qu’ils aient été excités vers des orbites plus hautes. Un atome ne peut pas avoir n’importe quelle énergie : les niveaux d’énergie sont étroitement définis par la structure atomique. Quand un électron passe d’une orbite à une autre, ce changement correspond à une quantité d’énergie précise, qui est émise sous forme d’un seul photon. L’énergie du photon détermine sa couleur.
Du fait des différents sauts possibles, chaque atome peut émettre tout un intervalle de couleurs distinctes. Si cette lumière est décomposée par un prisme ou une grille de diffraction, chaque couleur apparaît dans le spectre comme une raie d’émission : l’ensemble de ces raies s’appelle un spectre de raies.
Pour observer la formation d’une raie d’émission, regardons ce qu’il se passe lorsque du sel de table ordinaire (chlorure de sodium, NaCl) entre en contact avec la flamme d’une bougie. Les images ci-dessus montrent le spectre continu de la flamme elle-même, semblable à celui d’une ampoule à incandescence. Un peu de sel est déposé sur un couteau tenu dans la flamme : une raie orange apparaît alors distinctement dans le spectre. C’est une raie d’émission du sodium (Na, à 589 nm).
Non seulement un atome émet de la lumière, mais il peut également absorber des photons ayant la même énergie que ceux qu’il émet. Si de la lumière traverse un gaz froid à basse densité, les atomes du gaz absorbent des photons de fréquences spécifiques, ce qui provoque des raies sombres dans le spectre : ce sont des raies d’absorption.
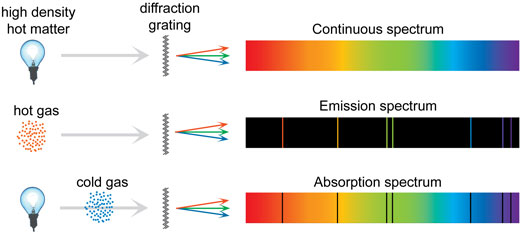
Image reproduite avec l’aimable autorisation de Mark Tiele Westra
Mais alors, si tous les atomes émettent de fines raies de différentes couleurs, comment les spectres continus sont-ils formés ? Pour un atome seul, isolé des effets extérieurs, les raies sont effectivement bien délimitées. C’est le cas pour un gaz à basse densité, comme dans les tubes fluorescents. Dans un gaz à plus haute pression, comme dans le soleil, mais aussi dans les fluides et les solides, il se produit de fréquentes collisions et beaucoup d’autres mécanismes qui rendent les raies plus floues, aboutissant à un spectre continu. Les trois types de spectres sont résumés par l’illustration ci-dessous.
Différents atomes et molécules présentent différents spectres d’émission et d’absorption. Cette différence peut être utile : rien qu’en regardant la lumière provenant d’un objet lointain, par exemple le Soleil ou une autre étoile, il est possible de dire quels éléments chimiques s’y trouvent. Sur Terre, une technique courante consiste à éclairer un échantillon (généralement un gaz) et à mesurer son spectre d’absorption afin de déterminer sa composition.
Le spectre solaire
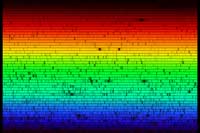
Tournons notre spectromètre vers l’extérieur, pour observer le spectre solaire (voir ci-dessous). À première vue, ce spectre semble continu. En regardant plus attentivement, on peut repérer plusieurs lignes sombres : elles sont dues à l’absorption de fréquences spécifiques par des atomes présents dans les couches externes du Soleil, ainsi que dans l’atmosphère de la Terre. L’image ci-dessous ne rend pas justice aux capacités de notre spectromètre : à l’oeil nu, les raies d’absorption sont beaucoup plus détaillées.
Les raies d’absorption que nous voyons dans le spectre solaire ont un nom : ce sont les raies de Fraunhofer. Joseph von Fraunhofer (1787-1826) fut le premier à accomplir une étude systématique et précise de ces lignes sombres, bien qu’il n’ait pas été le premier à les observer. Au total, il a répertorié plus de 570 raies, qu’il a classées et nommées.

Image reproduite avec l’aimable autorisation de Mark Tiele Westra
Aux alentours de 1860, Kirchoff et Bunsen ont découvert que chaque élément chimique est associé à un ensemble de raies spectrales. Ils en ont déduit que les raies de Fraunhofer étaient dues à l’absorption de couleurs spécifiques dans les couches externes du Soleil. Certaines de ces raies sont aussi causées par l’absorption de lumière par des atomes de l’atmosphère terrestre, comme l’oxygène. L’étude de ces raies a plus tard conduit à la découverte de l’hélium dans le Soleil ; ce qui a permis de prouver par la suite que l’énergie du Soleil est produite par fusion nucléaire.
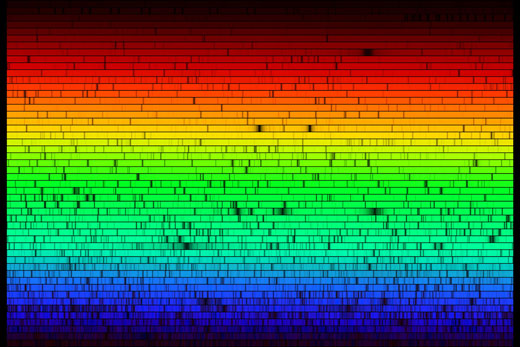
Image reproduite avec l’aimable autorisation du National Optical Astronomy Observatory / Association of Universities for Research in Astronomy/National Science Foundation
Remerciements
Je suis redevable à Xiaojin Zhu, de l’Université du Winsconsin-Madison, whose dont le site Internet m’a fourni toutes les informations nécessaires pour fabriquer le spectromètre et interpréter les résultats. D’autres spectres sont disponibles sur son site. Je remercie également Bartjan van der Meer, qui m’a lancé sur ce fantastique projet de science.
Resources
- Article Wikipedia sur le spectre visible
Informations générales sur les spectres
- Article Wikipedia sur le spectre électromagnétique
- Article Wikipedia sur la spectroscopie
- Article Wikipedia sur les raies de Fraunhofer
- Article Wikipedia sur les raies d’émission
Review
Cet article décrit une expérience “avec les mains” très intéressante, qui peut facilement être réalisée en classe ou à la maison. Le spectromètre est fabriqué avec du matériel courant. Il est utilisé pour montrer la décomposition de la lumière blanche en différentes couleurs, et pour comparer les spectres émis par différentes sources de lumières. L’arrière plan historique est particulièrement intéressant : la découverte du spectre solaire, et comment il fut utilisé pour déterminer la composition des gaz présents.
Cet article concerne la physique et la chimie. Il est intéressant pour les élèves du secondaire comme pour les étudiants de l’université.
Gaetano Bugeja, Malta





