Κλασική χημεία : Βρίσκοντας τον εμπειρικό τύπο Teach article
Παρακολουθήστε μία θεαματική χημική αντίδραση και κάντε μερικές προσεκτικές μετρήσεις για να…
Για κάθε χημική ένωση υπάρχει ένας χημικός τύπος. Στην πραγματικότητα, υπάρχουν πολλοί διαφορετικοί χημικοί τύποι για την οποιαδήποτε χημική ένωση (σχήμα 1). Ίσως ο πιο γνωστός τύπος είναι ο μοριακός τύπος – όπως για παράδειγμα ο Η2Ο για το νερό και ο CO2 για το διοξείδιο του άνθρακα – ο οποίος δείχνει τον αριθμό των διαφορετικών ατόμων σε κάθε μόριο. Ο συντακτικός τύπος πάει ένα βήμα πιο πέρα και δείχνει τον τρόπο με τον οποίο τα άτομα συνδέονται μεταξύ τους μέσα στο μόριο, κάτι που είναι ιδιαίτερα σημαντικό για τις οργανικές ενώσεις.
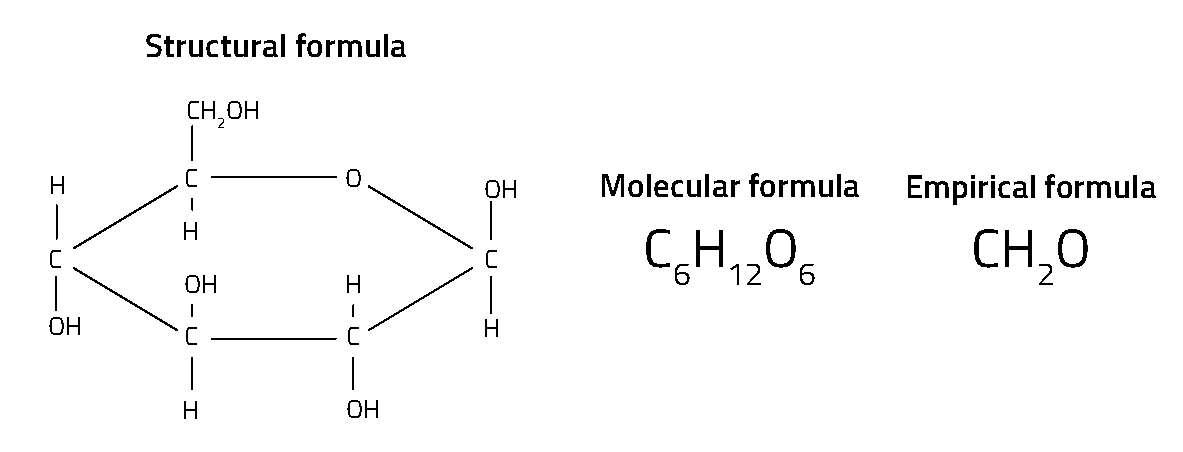
Ο απλούστερος χημικός τύπος είναι ο εμπειρικός τύπος, που δείχνει την αναλογία των διαφόρων ατόμων. Για παράδειγμα, ο μοριακός τύπος της γλυκόζης είναι C6H12O6, ενώ ο εμπειρικός τύπος της ένωσης αυτής είναι CH2O, που δείχνει ότι ο αριθμός των ατόμων υδρογόνου είναι διπλάσιος αυτού του άνθρακα και του οξυγόνου, αλλά όχι τον ακριβή αριθμό των ατόμων κάθε στοιχείου στο μόριο της ένωσης ή τον τρόπο που συνδέονται. Αυτοί οι απλοί τύποι, που στηρίζονται σε αναλογία ατόμων, αναπτύχθηκαν από τους πρώτους χημικούς τον 18ο αιώνα. Οι τύποι αυτοί είναι γνωστοί ως «εμπειρικοί» γιατί η αναλογία των ατόμων σε μία ένωση μπορεί να βρεθεί με παραδοσιακές τεχνικές της χημικής ανάλυσης μέσω πειράματος.

Caroline Evans
Σήμερα, το να βρίσκει κάποιος τον εμπειρικό τύπο πειραματικά αποτελεί σημαντικό στοιχείο των προγραμμάτων σπουδών χημείας σε όλον τον κόσμο. Αποτελεί, επίσης, το πρώτο στάδιο του προσδιορισμού του χημικού τύπου μίας άγνωστης ουσίας, καθιστώντας τη διαδικασία αυτή ένα χρήσιμο εργαλείο της χημικής ανάλυσης. Η κλασσική επίδειξη σε επίπεδο σχολείου συνίσταται στη θέρμανση μαγνησίου σε χωνευτήριο για την παρασκευή οξειδίου του μαγνησίου – μία θαμπή λευκή σκόνη. Στο παρόν άρθρο, περιγράφεται μία περισσότερο εντυπωσιακή εναλλακτική πρόταση : μία θεαματική αντίδραση κασσιτέρου και ιωδίου, που οδηγεί στην παραγωγή ενός έντονου ιώδους ατμού και λαμπερών πορτοκαλί κρυστάλλων καθώς η αντίδραση προχωρά.
Στόχος του πειράματος είναι ο υπολογισμός του λόγου μεταξύ των ατόμων κασσιτέρου και ιωδίου στον ιωδιούχο κασσίτερο. Αυτό γίνεται με την σύνθεση αυτής της ένωσης και μετρώντας με ακρίβεια τη μάζα των αντιδρώντων στην αρχή του πειράματος και των υπολειμμάτων του κασσιτέρου στο τέλος. Το πείραμα περιλαμβάνει μία σειρά τεχνικών, μεταξύ άλλων το στήσιμο και τη χρήση κάθετου ψυκτήρα και τη χρήση οργανικών διαλυτών για την εκχύλιση. Πέρα από το πρακτικό κομμάτι του υπολογισμού του εμπειρικού τύπου, το πείραμα συνδέεται και με περισσότερο θεωρητικά θέματα, όπως τα οφέλη από την χρήση αντιδρώντων σε περίσσεια, τη σύνθεση ενώσεων από τα συστατικά τους στοιχεία, και πως ο δεσμός συνδέεται με τη διαλυτότητα. Αποτελεί, επίσης, μία καθαρή εφαρμογή του νόμου διατήρησης της μάζας, που αποτελεί βασική αρχή στη χημεία (και την επιστήμη γενικά).
Ανάλογα με τον αριθμό απαγωγών που διαθέτει η τάξη, οι μαθητές μπορούν να εκτελέσουν οι ίδιοι το πείραμα, αλλά προσφέρεται και ως πείραμα επίδειξης από τον εκπαιδευτικό. Το πείραμα διαρκεί δύο ώρες περίπου και λειτουργεί καλύτερα σε ένα δίωρο μάθημα, αλλά είναι δυνατόν να σπάσει σε δύο μονόωρα μαθήματα. Είναι περισσότερο κατάλληλο για μαθητές ηλικίας 16 – 18, αλλά μπορεί να αξιοποιηθεί ως δραστηριότητα επέκτασης για μαθητές ηλικίας 14 – 16.
Υλικά
Ο εκπαιδευτικός (ή κάθε ομάδα μαθητών) θα χρειαστεί :
- 3 g ιωδίου
- 5 g κασσιτέρου, σε κομμάτια όχι μεγαλύτερα 1cm2
- 60 ml κυκλοεξανίου
- Προπανόνη
- Σφαιρική φιάλη 250 ml (για παράδειγμα τύπου Quickfit®)
- Ογκομετρικό κύλινδρο 100 ml
- Δύο ποτήρια ζέσης 250 ml
- Σφιγκτήρες
- Ηλεκτρικό μανδύα θέρμανσης
- Ψυκτήρα
- Παροχή νερού
- 2 μεγάλα φύλλα διηθητικού χαρτιού
- Ζυγό ακριβείας
- Εργαστηριακός αναβατήρας (προαιρετικά)
Οδηγίες ασφαλείας
Οι μαθητές θα πρέπει να φορούν εργαστηριακή ποδιά, γάντια και γυαλιά ασφαλείας. Το στερεό ιώδιο είναι διαβρωτικό και μπορεί να δημιουργήσει κηλίδες στο δέρμα, γι’ αυτό θα πρέπει να φορούν οι μαθητές γάντια. Το πείραμα θα πρέπει να διεξαχθεί σε έναν απαγωγό. Καθώς οι ατμοί του ιωδίου είναι τοξικοί, φροντίστε ώστε οι ιώδεις ατμοί δεν ανέρχονται σε ύψος μεγαλύτερο του 1/3 του ψυκτήρα κατά τη θέρμανση. Το κυκλοεξάνιο και η προπανόνη είναι ιδιαιτέρως εύφλεκτα, γι’ αυτό είναι απαραίτητος ο μανδύας θέρμανσης, ενώ θα πρέπει να φροντίσουμε να κρατάμε αυτούς τους δύο διαλύτες μακριά από φλόγες. Η προπανόνη θα πρέπει να απορρίπτεται σε μία φιάλη συγκέντρωσης υπολειμμάτων διαλυτών. Επιπλέον, οι εκπαιδευτικοί θα πρέπει να ακολουθούν τους τοπικούς κανόνες υγείας και ασφάλειας.
Διαδικασία
- Τοποθετήστε τη σφαιρική φιάλη των 250 ml στον ζυγό. Εισάγετε περίπου 3 g στερεού ιωδίου στη φιάλη, και καταγράψτε με ακρίβεια τη μάζα που προσθέσατε.
- Προσθέστε περίπου 5 g κασσιτέρου στη φιάλη και καταγράψτε με ακρίβεια τη μάζα του κασσιτέρου που χρησιμοποιήσατε.
- Σταθεροποιείστε τη φιάλη με έναν σφιγκτήρα στο λαιμό και προσθέστε 60 ml κυκλοεξανίου.

Ζυγίζοντας το ιώδιο (βήμα 1)
Caroline Evans
Κασσίτερος και ιώδιο στη φιάλη (βήμα 2)
Caroline Evans
Η φιάλη με τον κασσίτερο και το ιώδιο μετά από την προσθήκη κυκλοεξανίου (βήμα 3)
Caroline Evans - Τοποθετήστε τη φιάλη στον ηλεκτρικό μανδύα θέρμανσης. Ίσως επιθυμείτε να χρησιμοποιήσετε έναν εργαστηριακό αναβατήρα που θα σας επιτρέπει να ανυψώνετε και να χαμηλώνετε τον μανδύα θέρμανσης όταν κάτι τέτοιο απαιτείται.
- Συνδέστε έναν ψυκτήρα κάθετα στο λαιμό της φιάλης, βάλτε έναν σφιγκτήρα και συνδέστε τον ψυκτήρα με την παροχή του νερού.
- Θερμάνετε ελαφρά το μείγμα στη φιάλη έως ότου αρχίσει να βράζει.
- Μειώστε τη θερμοκρασία ώστε το μείγμα να βράζει σταθερά και οι ιώδεις ατμοί του ιωδίου να μην ανέρχονται σε ύψος μεγαλύτερο του 1/3 του ψυκτήρα.
- Συνεχίστε τη θέρμανση μέχρις ότου δεν υπάρχουν ίχνη ιώδους ατμού, και το υγρό που επιστρέφει πίσω στη φιάλη από τον ψυκτήρα είναι άχρωμο. Το υγρό στη φιάλη θα πρέπει να είναι πορτοκαλί. Ίσως χρειαστεί μία ώρα για να ολοκληρωθεί η διεργασία.
- Αφήστε το μίγμα στη φιάλη να κρυώσει.

Το σύστημα της φιάλης, του ψυκτήρα και του μανδύα θέρμανσης (βήματα 4-5)
Caroline Evans
Ανύψωση ατμών ιωδίου καθώς το μείγμα θερμαίνεται (βήμα 7)
Caroline Evans
Σχηματισμός πορτοκαλί υγρού (βήμα 8)
Caroline Evans - Στον απαγωγό, μεταφέρατε το πορτοκαλί υγρό από τη φιάλη σε ένα ποτήρι ζέσης, φροντίζοντας να μην περάσουν στο ποτήρι υπολείμματα του κασσιτέρου.
- Εισάγετε μία μικρή ποσότητα προπανόνης στη σφαιρική φιάλη και αναδεύστε ώστε να διαλυθεί η όποια ποσότητα ιωδιούχου κασσιτέρου υπάρχει στη φιάλη μαζί με την περίσσεια στερεού κασσιτέρου. Απομακρύνατε προσεκτικά τα εκπλύματα προπανόνης σε ένα άλλο ποτήρι ζέσης. Επαναλάβετε αυτή τη διαδικασία ανάδευσης έως ότου η προπανόνη που μεταφέρετε από τη φιάλη στο ποτήρι ζέσης είναι άχρωμη. Με αυτόν τον τρόπο εξασφαλίζεται ότι ο εναπομείνας στερεός κασσίτερος δεν περιέχει καθόλου πορτοκαλί ιωδιούχο κασσίτερο.
- Αφήστε το ποτήρι ζέσης με το πορτοκαλί υγρό (βήμα 10) στον απαγωγό όλο το βράδυ για να εξατμισθεί ο διαλύτης και να σχηματισθούν ωραίοι πορτοκαλί κρύσταλλοι ιωδιούχου κασσιτέρου. (Μπορείτε να τους δείτε στο επόμενο μάθημα.)
- Μεταφέρατε τον κασσίτερο που δεν αντέδρασε από τη φιάλη στο τέλος του πειράματος σε δύο μεγάλα φύλλα διηθητικού χαρτιού. Αφήστε το χαρτί και τον κασσίτερο να στεγνώσουν στον αέρα, και στη συνέχεια ζυγίστε και καταγράψτε τη μάζα του κασσιτέρου που δεν αντέδρασε.
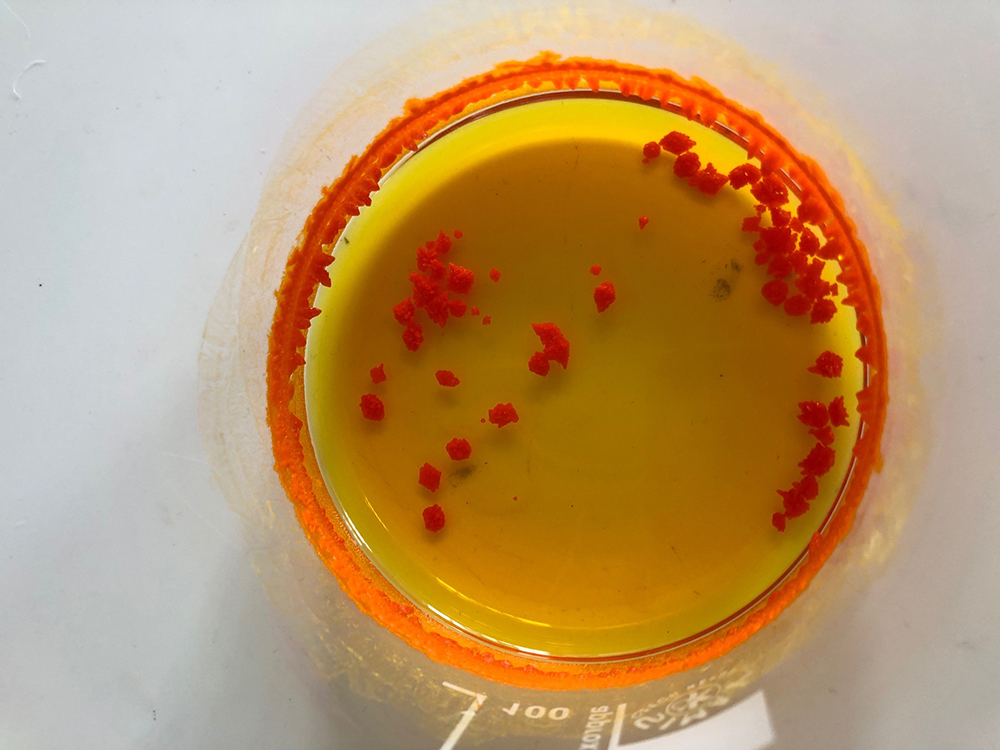
Σχηματισμός κρυστάλλων ιωδιούχου κασσιτέρου (βήμα 12)
Caroline Evans
Ο κασσίτερος που δεν αντέδρασε, στεγνώνει στο διηθητικό χαρτί (βήμα 13)
Caroline Evans
Προσδιορίζοντας τον εμπειρικό τύπο
Στο πείραμα αυτό δύο στοιχεία – ο κασσίτερος και το ιώδιο – αντιδρούν στη στοιχειακή τους μορφή και παράγεται η ένωση ιωδιούχος κασσίτερος. Ο κασσίτερος έχει περισσότερες από μία οξειδωτικές καταστάσεις, και συνεπώς το προϊόν μπορεί να είναι ή ο ιωδιούχος κασσίτερος (ΙΙ) (SnI2) ή ο ιωδιούχος κασσίτερος (IV) (SnI4). Αξιοποιώντας τα πειραματικά δεδομένα, μπορούμε να βρούμε τον εμπειρικό τύπο του προϊόντος, και να εξάγουμε συμπεράσματα για τον λόγο ατόμων κασσιτέρου – ιωδίου. Επίσης, μπορούμε να ταυτοποιήσουμε την ένωση του κασσιτέρου που παράγεται.
- Το πρώτο βήμα συνίσταται στο να υπολογίσουμε τη μάζα του ιωδίου και του κασσιτέρου που καταναλώθηκαν στην αντίδραση. Το ιώδιο καταναλώνεται πλήρως στην αντίδραση (το αντιδρών σε έλλειμα, με τον κασσίτερο να είναι σε περίσσεια), και έτσι μπορούμε να αξιοποιήσουμε την ακριβή μάζα του ιωδίου που ζυγίσαμε στο βήμα 1.
- Για να υπολογίσουμε τη μάζα του κασσιτέρου που καταναλώθηκε στην αντίδραση, αρκεί να αφαιρέσουμε τη μάζα του κασσιτέρου που έμεινε στο τέλος της αντίδρασης από την αρχική μάζα.
Κασσίτερος που καταναλώθηκε στην αντίδραση = αρχική μάζα (βήμα 2) πλην μάζα που περίσσεψε (βήμα 13)
- Τώρα θα πρέπει να μετατρέψουμε τις μάζες σε mol, για να βρούμε τον αριθμό των ατόμων κασσιτέρου και ιωδίου που συμμετείχαν στην αντίδραση. Για τη μετατροπή, διαιρούμε την τιμή της κάθε μάζας (από τα βήματα 14 και 15) με τη σχετική ατομική μάζα (Ar) κάθε στοιχείου. Το αποτέλεσμα κάθε διαίρεσης θα μας δώσει τον αριθμό των mol κάθε στοιχείου που συμμετείχαν στην αντίδραση (καθώς και στην τελική ένωση).
- Για να βρούμε τον εμπειρικό τύπο του ιωδιούχου κασσιτέρου, πρέπει να βρούμε τον αριθμό των mol του ιωδίου που αντέδρασε για κάθε mol κασσιτέρου. Γι’ αυτό, διαιρούμε τα πηλίκα που υπολογίσαμε στο βήμα 16 με τον αριθμό των mol κασσιτέρου που καταναλώθηκαν (που θα μας δώσει τον αριθμό των mol ιωδίου που συνδυάζονται με ένα mol κασσιτέρου). Ίσως χρειαστεί να στρογγυλοποιήσουμε το λόγο που θα προκύψει ώστε να μην έχουμε δεκαδικούς αριθμούς. Για παράδειγμα ο λόγος κασσιτέρου προς ιώδιο 1 : 3.6 μπορεί να στρογγυλοποιηθεί σε 1 : 4.
- Τελικά, μπορούμε να γράψουμε τον εμπειρικό τύπο. Για παράδειγμα, ο λόγος 1 : 4 σημαίνει ότι ο εμπειρικός τύπος είναι SnI4. Εσείς ποιον εμπειρικό τύπο βρήκατα ;
Συζήτηση
Αυτή η δραστηριότητα μπορεί να δώσει καλά αποτελέσματα αν διεξαχθεί με προσοχή, και να προκύψουν τιμές πολύ κοντά στο λόγο 1 : 4 (ως ο λόγος κασσιτέρου προς ιώδιο). Αυτό δίνει τον τύπο SnI4 ως εμπειρικό τύπο για τον ιωδιούχο κασσίτερο.
Γενικά, συχνά προκύπτουν τιμές που κυμαίνονται μεταξύ του 1 : 3.2 και του 1 : 3.8. Καθώς οι συνηθισμένοι αριθμοί οξείδωσης του κασσιτέρου είναι +2 και +4, ένας λόγος που προκύπτει πειραματικά και είναι κοντά στον 1 : 3 δεν θα είναι αποδεκτός. Παρ’ όλα αυτά, τέτοιες τιμές μπορούν να αποτελέσουν αφορμή για μία συζήτηση σχετικά με τις πηγές πειραματικών σφαλμάτων και τη σημασία της ακρίβειας.
Πηγές σφαλμάτων κατά τις πειραματικές μετρήσεις
Μετά το πείραμα, ρωτήστε όλους τους μαθητές για πιθανές πηγές σφαλμάτων. Πως μπορεί να επηρεάσει το καθένα από τα παρακάτω τα τελικά αποτελέσματα ;
- Ακρίβεια του ζυγού που χρησιμοποιήθηκε
- Ατελής αντίδραση του ιωδίου
- Απώλεια ατμών ιωδίου από τον ψυκτήρα
- Ελλιπής έκπλυση κασσιτέρου που απέμεινε
- Απώλεια κασσιτέρου κατά την έκπλυση με προπανόνη
- Ατελής ξήρανση του κασσιτέρου πριν την καταγραφή της μάζας
Ο πίνακας 1 συνοψίζει την επίδραση που θα έχει κάθε μία από αυτές τις πηγές σφαλμάτων στο πείραμα και το τελικό αποτέλεσμα – δηλαδή, πως κάθε σφάλμα αλλάζει την τιμή του x στον εμπειρικό τύπο SnIx.
| Σφάλμα | Επίδραση : στη μάζα του κασσιτέρου που απέμεινε | Επίδραση : στη μάζα του κασσιτέρου που αντέδρασε (αρχική μάζα μείον η μάζα αυτού που απέμεινε) | Επίδραση : στην τιμή του x (στο SnIx) |
|---|---|---|---|
| Ατελής αντίδραση ιωδίου | Αύξηση, καθώς δεν αντιδρά όλος ο κασσίτερος | Μείωση | Αύξηση |
| Απώλεια κασσιτέρου που δεν αντέδρασε κατά την έκπλυση με προπανόνη | Μείωση | Αύξηση | Μείωση |
| Ατελής ξήρανση του κασσιτέρου που απέμεινε | Αύξηση, με προσθήκη επιπλέον ποσότητας διαλύτη | Μείωση | Αύξηση |
| Ανεπαρκής έκπλυση κασσιτέρου που απέμεινε | Αύξηση, καθώς μικρή ποσότητα ιωδιούχου κασσιτέρου υπάρχουν στα υπολείμματα του κασσιτέρου | Μείωση | Αύξηση |
| Απώλεια ατμών ιωδίου από τον ψυκτήρα | Αύξηση, καθώς δεν ήταν δυνατόν να αντιδράσει όλος ο κασσίτερος | Μείωση | Αύξηση |
Περαιτέρω συζήτηση : διαλυτότητα και είδος δεσμού
Το πείραμα αυτό επίσης δίνει την ευκαιρία για να συζητήσει κανείς πώς το είδος του δεσμού συνδέεται με τη διαλυτότητα. Τόσο το ιώδιο όσο και ο ιωδιούχος κασσίτερος διαλύονται σε μη πολικούς διαλύτες (κυκλοεξάνιο και προπανόνη) όχι όμως στο νερό, ενώ ο κασσίτερος ως μέταλλο είναι αδιάλυτος στο κυκλοεξάνιο, την προπανόνη και το νερό. Αξιοποιώντας αυτή την πληροφορία, μπορούν οι μαθητές σας να βγάλουν συμπεράσματα για τους πιθανούς δεσμούς σε αυτές τις ενώσεις ;
Ευχαριστίες
Η συγγραφέα θα ήθελε να ευχαριστήσει τον Alan Carter, που διετέλεσε επικεφαλής της Χημείας στο Κολλέγιο Wellington (Μπερκσάιρ, Ηνωμένο Βασίλειο) μέχρι το 2004, και ο οποίος δημιούργησε τον αρχικό πόρο που ενέπνευσε αυτό το άρθρο.
Resources
- Βρείτε περισσότερα σχετικά με τις οξειδωτικές καταστάσεις του κασσιτέρου στην ιστοσελίδα Chemguide.
- Μάθετε για ένα εναλλακτικό πείραμα για την εξαγωγή του εμπειρικού τύπου, αυτή τη φορά του οξειδίου του χαλκού (ΙΙ) στην ιστοσελίδα της Royal Society of Chemistry.
Review
Το άρθρο αυτό περιγράφει ένα θεαματικό πείραμα προσδιορισμού του εμπειρικού τύπου μίας ένωσης που έχει προκύψει από την αντίδραση στοιχείων της. Αυτή η πρακτική άσκηση προσφέρει στους μαθητές τη δυνατότητα να υπερβούν τις αριθμητικές ασκήσεις όταν προσδιορίζουν χημικούς τύπους.
Το πείραμα αυτό είναι κατάλληλο για φοιτητές χημείας που παρακολουθούν αναλυτική χημεία. Εμπεριέχει μία ευρεία ποικιλία πειραματικών τεχνικών για μπορεί να δώσει το έναυσμα για να συζητήσει κανείς τις διάφορες πηγές σφάλματος κατά τη διάρκεια των πειραματικών μετρήσεων. Επίσης, μπορεί να αποτελέσει αφορμή για άλλα βασικά θέματα, όπως το πως συνδέεται το είδος του δεσμού με τη διαλυτότητα.
Όλα τα υλικά που απαιτούνται μπορούν εύκολα να τα αποκτηθούν και οι οδηγίες εύκολα να ακολουθηθούν, καθιστώντας τις δραστηριότητες κατάλληλες για μαθητές να εργαστούν σε ομάδες.
Mireia Güell Serra, καθηγήτρια χημείας και μαθηματικών, σχολείο INS Cassà de la Selva, Ισπανία





