Χρωματιστή Χημεία : οξειδοαναγωγικές αντιδράσεις με γλειφιτζούρια Teach article
Χρησιμοποιήστε ένα γλειφιτζούρι για να ενεργοποιήστε οξειδοαναγωγικές αντιδράσεις συνοδευόμενες από…
Η διδασκαλία των οξειδοαναγωγικών αντιδράσεων αποτελεί μέρος όλων των προγραμμάτων σπουδών χημείας δευτεροβάθμιας εκπαίδευσης. Σε αυτό το άρθρο, περιγράφεται μία παρουσίαση συνοδευόμενη από ζωηρή αλλαγή χρωμάτων για να δείξουμε μία σειρά διαδοχικών οξειδοαναγωγικών αντιδράσεων, στη διάρκεια των οποίων ηλεκτρόνια μεταφέρονται μεταξύ διαφορετικών ενώσεων και ιόντων. Η δραστηριότητα είναι κατάλληλη ως πείραμα επίδειξης από τον εκπαιδευτικό, αλλά μπορεί να εκτελεσθεί από μεγαλύτερης ηλικίας μαθητές.

Η εικόνα είναι ευγενική προσφορά του Ian Redding/Shutterstock.com
Οξειδωτικά και αναγωγικά σώματα
Οξειδοαναγωγική καλείται κάθε αντίδράση στην οποία ένα μόριο, άτομο ή ιόν προσλαμβάνει ή αποβάλλει ηλεκτρόνια, αλλάζοντας την οξειδωτική του κατάσταση. Το οξειδωτικό μέσο προσλαμβάνει ηλεκτρόνια (και ανάγεται στην αντίδραση) και το αναγωγικό μέσο αποβάλλει ηλεκτρόνια (και οξειδώνεται στην αντίδραση). Σε αυτό το πείραμα, γλυκόζη από ένα γλειφιτζούρι χρησιμοποιείται ως αναγωγικό μέσο. Όταν η γλυκόζη προστίθεται σε ένα διάλυμα που περιέχει ιόντα OH– , πραγματοποιούνται μία σειρά ημιαντιδράσεων, με μία από αυτές να περιλαμβάνει την προσφορά ηλεκτρονίων από τις αλδεϋδομάδες της γλυκόζης. Αυτό έχει ως αποτέλεσμα το σχηματισμό καρβοξυλομάδων με τη μορφή ανιόντων καρβοξυλίου (λόγω του αλκαλικού μέσου) :
–CHO + 3 OH– → –COO- + 2 H2O + 2 e–
(αλδεϋδομάδα) (καρβοξυλομάδα, με τη μορφή ανιόντος καρβοξυλίου)
Επιπλέον, οι αλκοολικές ομάδες στην γλυκόζη επίσης προσφέρουν ηλεκτρόνια, οδηγώντας στο σχηματισμό καρβοξυλομάδων (στην περίπτωση των πρωτοταγών αλκοολών) και κετονομάδων (στην περίπτωση των δευτεροταγών αλκοολών) :
–C(H)(OH)– + 2OH– → –C(=O)– + 2H2O + 2e–
(δευτεροταγής αλκοόλη) (κετονομάδα)
Στο πείραμα μας, γλυκόζη προστίθεται σε διάλυμα υπερμαγγανικών ιόντων παρουσία υδροξειδίου του νατρίου (NaOH), με αποτέλεσμα ηλεκτρόνια από τη γλυκόζη (C6H12O6) να προσφέρονται στα υπερμαγγανικά ιόντα (MnO4–). Τα προϊόντα οξείδωσης του αναγμένου σακχάρου είναι κυρίως γλουκονικό οξύ (C6H10O7), και σε μικρό ποσοστό αραβονικό οξύ (C5H10O6) και μυρμηκικό οξύ (CH2O2). Αν το γλειφιτζούρι περιέχει φρουκτόζη, που είναι ισομερές της γλυκόζης, το κύριο προϊόν είναι το φρουκτονικό οξυ (επίσης C6H10O7)
Σε μία σειρά οξειδοαναγωγικών αντιδράσεων, ηλεκτρόνια προσφέρονται συνεχώς από τη γλυκόζη σε διαδοχικές ενώσεις του μαγγανίου. Σε κάθε αντίδραση στην αλληλουχία των αντιδράσεων, γίνεται ορατή μια χρωματική μεταβολή. Το μαγγάνιο είναι ιδανικό για αυτό το πείραμα, καθώς έχει τις πιο πολλές σταθερές οξειδωτικές καταστάσεις από οποιοδήποτε άλλο μεταβατικό μέταλλα (από +2 σε +7), με κάθε μία να έχει διαφορετικό χρώμα.
Μπορεί να γνωρίζετε την κλασική επίδειξη του «χημικού χαμαιλέοντα»w1, της οποίας μία προσαρμογή αποτελεί το πείραμα αυτό. Στην αρχική εκδοχή, ξεκινάτε με ένα διάλυμα υπερμαγγανικού καλίου και γλυκόζης, του οποίου το χρώμα αλλάζει κατά την ανάδευσή του με μία σπάτουλα. Χρησιμοποιώντας κανείς ένα γλειφιτζούρι, η γλυκόζη προστίθεται σταδιακά στο διάλυμα, οπότε μπορεί κανείς να παρακολουθήσει ευκολότερα τις εναλλαγές των χρωμάτων. Χρησιμοποιώντας έναν μικρό ηλεκτρικό αναδευτήρα, το γλειφιτζούρι αναδεύεται πιο γρήγορα απ’ ότι με το χέρι.
Υλικά
Θα χρειαστείτε τα ακόλουθα υλικά (δείτε το σχήμα 1) :
- Κρυστάλλους υπερμαγγανικού καλίου (KMnO4)
- Σφαιρικά γλειφιτζούρια με γλυκόζη (ή άλλο αναγωγικό ζάχαρο, π.χ φρουκτόζη)
- 3-4 πέλλετ υδροξειδίου του νατρίου (NaOH) (περίπου 0.5 g)
- 200 ml απεσταγμένο νερό
- Κωνική φιάλη ή ποτήρι ζέσης των 250 ml (γυάλινα ή πλαστικά)
- Κουταλάκι και σπάτουλα
- Μικρός ηλεκτρικός αναδευτήρας, π.χ χειρός για αφρόγαλα
- Λευκοπλάστης

Η εικόνα είναι ευγενική προσφορά της Marisa Prolongo
Σημείωση για την ασφάλεια
Συνίσταται η χρήση εργαστηριακής ποδιάς, γαντιών και γυαλιών ασφαλείας. Οι εκπαιδευτικοί θα πρέπει να εφαρμόζουν τους εθνικούς κανόνες υγιεινής και ασφάλειας, ιδιαιτέρως σε ότι αφορά τη χρήση του υπερμαγγανικού καλίου και την διάθεση των διαλυμάτων που προκύπτουν. Δείτε επίσης τους γενικούς κανόνες ασφαλείας.
Διαδικασία
Η δράση είναι κατάλληλη για μία διδακτική ώρα. Το πείραμα ολοκληρώνεται σε 15 λεπτά και μετά μπορούν να διατυπωθούν διάφορα ερωτήματα προς συζήτηση.
Τα βήματα είναι τα ακόλουθα :
- Γεμίστε τη φιάλη ή το ποτήρι ζέσης με 200 mL απεσταγμένου νερού.
- Αναδεύστε τα πέλλετς του NaOH με το κουτάλι μέχρι να διαλυθούν πλήρως.
- Χρησιμοποιώντας τη σπάτουλα, προσθέστε λίγους κρυστάλλους υπερμαγγανικού καλίου (όχι πάρα πολλούς, διαφορετικά το χρώμα θα είναι πολύ σκούρο καθιστώντας αδύνατη την παρατήρηση αλλαγής χρώματος). Όταν προστίθεται υπερμαγγανικό κάλιο σε αλκαλικό με NaOH διάλυμα υπερμαγγανικού καλίου (KMnO4), διίσταται σε ιόντα καλίου(K+)και υπερμαγγανικά ιόντα (MnO4–).
- Στηρίξτε το ξυλάκι του ξετυλιγμένου γλειφιτζουριού στον αναδευτήρα και ξεκινήστε την ανάμιξη (δείτε το σχήμα 1).
- Εισάγετε το γλειφιτζούρι στο διάλυμα και ενεργοποιήστε τον αναδευτήρα για να ξεκινήσει η ανάμειξη.
Καθώς το γλειφιτζούρι διαλύεται στο διάλυμα, θα παρατηρήσετε μεταβολές στο χρώμα του διαλύματος για κάθε οξειδοαναγωγική αντίδραση. Οι πρώτες δύο αλλαγές συμβαίνουν ταχύτατα (σε 3 – 5 δευτερόλεπτα), ενώ οι περαιτέρω μεταβολές γίνονται πιο αργές. Οι μαθητές μπορούν να τραβούν φωτογραφίες (π.χ με την κάμερα κάποιου κινητού τηλεφώνου) σε διαφορετικές χρονικές στιγμές για καλύτερη σύγκριση και παρακολούθηση των μεταβολών στα χρώματα. Βίντεο από τους συγγραφείς του άρθρου στη διάρκεια της παρουσίασης του πειράματος είναι διαθέσιμο στην ισπανική γλώσσαw2.
Τι συμβαίνει στο πείραμα ;
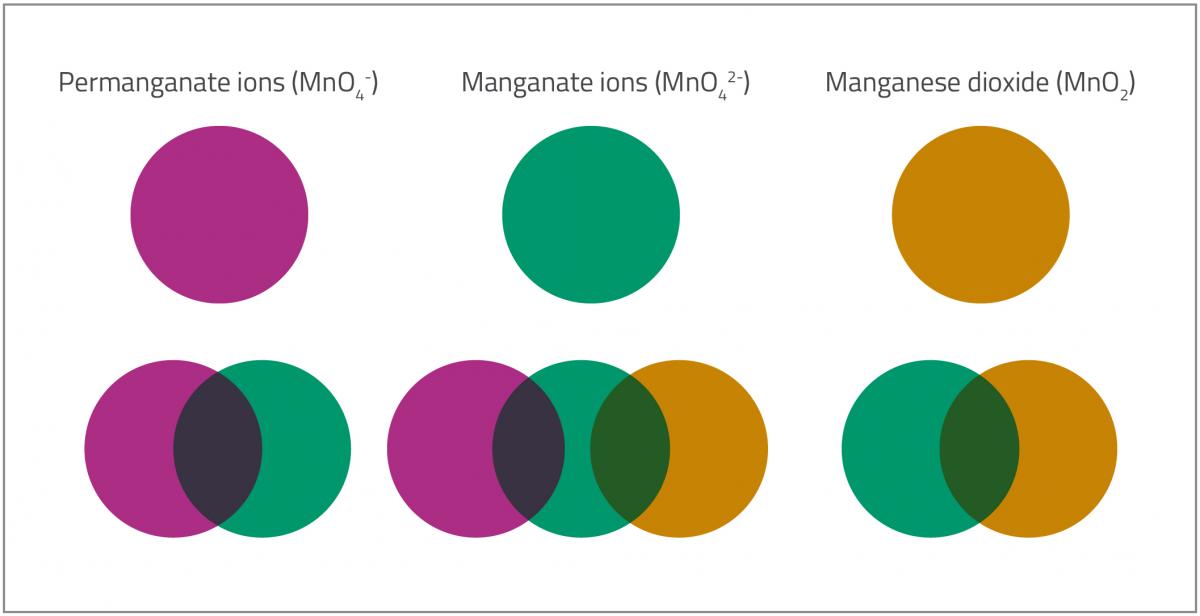
Καθώς το γλειφιτζούρι διαλύεται στο διάλυμα με τα ιόντα του μαγγανίου, κανείς μπορεί να διακρίνει τουλάχιστον πέντε διαφορετικά χρώματα (όπως φαίνεται στο σχήμα 2), που αντιστοιχούν στις διαφορετικές οξειδωτικές καταστάσεις του μαγγανίου.
- Το πρώτο χρώμα (ιώδες) αντιστοιχεί στα υπερμαγγανικά ιόντα (MnO4–). Το μαγγάνιο έχει αριθμός οξείδωσης +7.
- Τα υπερμαγγανικά ιόντα (MnO4–) ανάγονται σε μαγγανικά ιόντα (MnO42–). Ο αριθμός οξείδωσης του μαγγανίου μεταβάλλεται από +7 σε +6, και το χρώμα αλλάζει από ιώδες σε πράσινο.MnO4–(aq) (ιώδες) + e– → MnO42–(aq) (πράσινο)Μεταξύ των βημάτων 1 και 2 μπορεί κανείς να διακρίνει ένα μπλε χρώμα. Μία εξήγηση είναι ότι το μείγμα περιέχει και τα ιώδη υπερμαγγανικά ιόντα (MnO4–) και τα πράσινα μαγγανικά ιόντα (MnO42–), τα οποία συνδυαζόμενα δίνουν το μπλε χρώμα στο διάλυμα. Άλλη εξήγηση είναι αυτή που δέχεται ότι ένα μέρος των υπερμαγγανικών ιόντων ανάγεται σε υπομαγγανικά ιόντα (MnO43–), στα οποία το μαγγάνιο έχει αριθμό οξείδωσης +5 και μπλε χρώμα.
MnO4–(aq) (ιώδες) + 2e– → MnO43–(aq) (μπλε)
- Τα μαγγανικά ιόντα (MnO42–), όπου το μαγγάνιο έχει αριθμό οξείδωσης +6, ανάγονται περεταίρω σε διοξείδιο του μαγγανίου (MnO2), με το μαγγάνιο να εμφανίζει αριθμό οξείδωσης +4, προκαλώντας μία αλλαγή του χρώματος από πράσινο σε καφέ-κίτρινο.MnO42–(aq) (πράσινο) + 2 H2O(l) + 2e– → MnO2(s) + 4OH–(aq) (καφεκίτρινο)
- Στο τέλος, καθώς περισσότερη γλυκόζη προστίθεται στο διάλυμα, το διοξείδιο του μαγγανίου (MnO2), χρώματος καφέ-μαύρου σχηματίζει ένα κολοειδές αιώρημα σε αλκαλικό περιβάλλον, το οποίο (σε ελαφρά διάλυση) μπορεί να εμφανιστεί πορκτοκαλί.

Η εικόνα είναι ευγενική προσφορά της Marisa Prolongo
Διαφοροποιήσεις στα χρώματα
Τα χρώματα που χρησιμοποιούνται στα τρόφιμα και που υπάρχουν στα γλειφιτζούρια δεν επηρεάζουν σε μεγάλο βαθμό τα χρώματα που παρατηρείτε σε αυτό το πείραμα, υπάρχουν όμως άλλοι παράγοντες που παίζουν κάποιο ρόλο. Αφού ξεκινήσει η αντίδραση, υπάρχουν συνεχώς μείγματα ιόντων στο διάλυμα, με αποτέλεσμα μία μίξη χρωμάτων που δεν είναι πάντοτε εύκολο να ερμηνευτεί (δείτε το σχήμα 3).
Ένας άλλος παράγοντας είναι ότι το χρώμα των ιόντων του μαγγανίου στο διάλυμα είναι γενικά διαφορετικό από το χρώμα των αντίστοιχων αλάτων τους σε στερεή κατάσταση. Αυτό συμβαίνει διότι τα ιόντα μαγγανίου σχηματίζουν σύμπλοκα με το νερό λόγω της ικανότητας πρόσληψης ηλεκτρονίων των d ατομικών τους τροχιακών. Επιπλέον, η τάση των μορίων να δέχονται ηλεκτρόνια ποικίλει ανάλογα με την τιμή του pH και τη θερμοκρασία. Έτσι, αν αλλάξετε αυτές τις μεταβλητές ή τις ποσότητες των αντιδραστηρίων, τα χρώματα θα διαφέρουν, και οι αλλαγές των χρωμάτων θα συμβαίνουν σε διαφορετικούς χρόνους μεταξύ των πειραμάτων.
Η εικόνα είναι ευγενική προσφορά του Nicola Graf
Permanganate ions (MnO4-): yπερμαγγανικά ιόντα (MnO4-); Manganate ions (MnO42-): mαγγανικά ιόντα (MnO42-); Manganese dioxide (MnO2): Οξείδιο του Μαγγανίου (MnO2).
Ηλεκτρονική διαμόρφωση και μέταλλα μετάπτωσης
Τα ηλεκτρόνια είναι κατανεμημένα σε ενεργειακά επίπεδα που ονομάζονται στοιβάδες. Κάθε στοιβάδα υποδιαιρείται σε υποστοιβάδες που με τη σειρά τους αποτελούνται από τροχιακά. Τα μέταλλα μετάπτωσης έχουν ένα ή περισσότερα ηλεκτρόνια σε d-τροχιακά. Η διαφορά ενέργειας ανάμεσα στα ηλεκτρόνια που καταλαμβάνουν d-τροχιακά είναι σχετικά μικρή, με αποτέλεσμα τα κατιόντα όλων των μετάλλων μετάπτωσης να εμφανίζουν μια ποικιλία στον τρόπο που σχηματίζουν χημικούς δεσμούς με τη συμμετοχή διαφορετικού αριθμού ηλεκτρονίων σε d-τροχιακά. Αυτός είναι ο λόγος που τα μέταλλα μετάπτωσης εμφανίζουν αρκετές οξειδωτικές καταστάσεις.
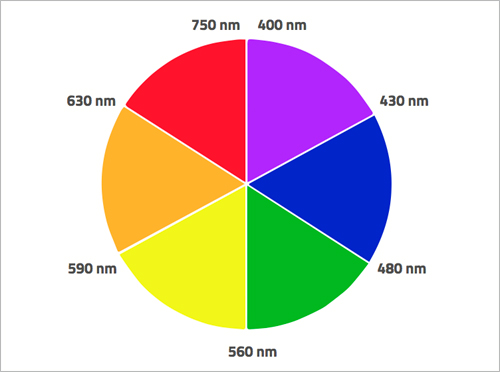
Όταν τα ηλεκτρόνια απορροφούν ηλεκτρομαγνητική ακτινοβολία συγκεκριμένης συχνότητας, μεταβαίνουν σε υψηλότερο ενεργειακό επίπεδο. Σε πολλά μέταλλα μετάπτωσης, η διαφορά ενέργειας μεταξύ των d-τροχιακών αντιστοιχεί στην ενέργεια ακτινοβολίας του ορατού φωτός. Για παράδειγμα, τα ηλεκτρόνια σε d-τροχιακά των υπερμαγγανικών ιόντων απορροφούν ηλεκτρομαγνητική ακτινοβολία στην κίτρινη περιοχή του ορατού φάσματος, αλλά αυτό που βλέπουμε ως χρώμα των υπερμαγγανικών ιόντων είναι το συμπληρωματικό του κίτρινου – που είναι το ιώδες.
Η εικόνα είναι ευγενική προσφορά του Nicola Graf
Συζήτηση
Για να συνδέσετε την επίδειξη με το γλειφιτζούρι με τη χημεία των οξειδοαναγωγικών αντιδράσεων, ρωτήστε του μαθητές μερικές από τις ακόλουθες ερωτήσεις :
- Στο πείραμα, ποιο είναι το αναγωγικό σώμα που προσφέρει ηλεκτρόνια στις οξειδοαναγωγικές αντιδράσεις ; Αυτό εξαρτάται από το αναγωγικό σάκχαρο που χρησιμοποιείται, αλλά στο πείραμά μας το αναγωγικό σώμα είναι η γλυκόζη (C6H12O6).
- Ποιο είναι το οξειδωτικό σώμα που δέχεται τα ηλεκτρόνια ;
Το πρώτο οξειδωτικό σώμα στην αντίδραση είναι τα υπερμαγγανικά ιόντα. Στη συνέχεια, ηλεκτρόνια προσφέρονται στα μαγγανικά ιόντα. - Το μαγγανικό κάλιο στο διάλυμα απορροφούν το τμήμα του ορατού φάσματος που αντιστοιχεί στο χρώμα που βλέπουμε (πράσινο) ή στο συμπληρωματικό του (κόκκινο) ;
Το μαγγανικό κάλιο απορροφά ηλεκτρομαγνητική ακτινοβολία από την κόκκινη περιοχή του ορατού φάσματος, αλλά αυτό που εμείς βλέπουμε ως χρώμα των μαγγανικών ιόντων είναι το συμπληρωματικό χρώμα, δηλαδή το πράσινο. - Γνωρίζετε άλλα χημικά στοιχεία που εμφανίζονται, σε διάλυμά τους, με διαφορετικό χρώμα σε διαφορετικές καταστάσεις οξείδωσης ;Τα παραδείγματα περιλαμβάνουν : χρώμιο (Cr2O72–, πορτοκαλί ; CrO42–, κίτρινο και βανάδιο (V2+, ιώδες ; V3+, πράσινο; VO2+, μπλε ; VO43–, κίτρινο)
- Ποιες είναι οι κύριες χρήσεις του μαγγανίου, για παράδειγμα στην βιολογία ή τη βιομηχανία ;Οι ενώσεις του μαγγανίου χρησιμοποιούνται στο ανοξείδωτο ατσάλι και τις μπαταρίες, και σαν πρόσθετο καυσίμων και στις χρωστικές. Το μαγγάνιο αποτελεί, επίσης, σημαντικό συμπαράγοντα πολλών ενζύμων, όπως το φωτοσύστημα ΙΙ στους χλωροπλάστες. Παρ’ όλα αυτά, σε μεγάλες ποσότητες καθίσταται τοξικός για τον άνθρωπο.
Παραλλαγές του πειράματος
Αυτό το πείραμα μπορεί να εκτελεστεί με διάφορους τρόπους. Για παράδειγμα, αντί του να χρησιμοποιήσει κάποιος ένα γλειφιτζούρι, μπορεί να χρησιμοποιήσει μία τσίχλα που να περιέχει ζάχαρη ως το οξειδωτικό μέσο · ή αντί της προσθήκης γλυκόζης σε μία κωνική φιάλη, μπορεί κάποιος να την προσθέσει σε μία πλαστική φιάλη και να την αναδεύσει προκειμένου να παρατηρήσει τις αλλαγές των χρωμάτων ( σχήμα 5). Οι μαθητές σας θα μπορούσαν να αξιοποιήσουν τη δημιουργικότητά τους για να σκεφτούν εναλλακτικά πειράματα.

Η εικόνα είναι ευγενική προσφορά της Marisa Prolongo
Ευχαριστίες
Το άρθρο στηρίζεται σε μία παρουσίαση που πραγματοποιήθηκε στα πλαίσια του Ισπανικού φεστιβάλ «Η επιστήμη επί σκηνής»(Ciencia en Acción) το 2014. Αυτή η εργασία έγινε για πρώτη φορά από μαθητές του γυμνασίου Manuel Romero της Μάλαγα στην Ισπανία. Ευχαριστούμε για την υποστήριξή τους το Πολυτεχνείο της Μαδρίτης (Universidad Politécnica de Madrid) για τις δράσεις «Προώθηση της πειραματικής μάθησης της Χημείας» και «Chem-Innova», καθώς και την Ισπανική Βασιλική Εταιρεία Χημείας (Real Sociedad Española de Química, RSEQ).
Web References
- w1 – Για παραλλαγές του πειράματος επισκεφτείτε το Science Brothers website και το Hobby Chemistry website.
- w2 – Βίντεο του πειράματος είναι διαθέσιμο στα Ισπανικά στο YouTube και στο IES Manuel Romero Secondary School website.
Resources
- Για ιδέες για την εισαγωγή στις οξειδοαναγωγικές αντιδράσεις με τη χρήση παραδειγμάτων από την καθημερινότητα δείτε :
- Voak H (2016) Redox resources. Science in School 36.
- Για να δοκιμάσετε πειράματα με χρωματικές μεταβολές που να περιλαμβάνουν ευαίσθητες στο pH φυτικές χρωστικές, δείτε :
- Shimamoto GG, Vitorino Rossi A (2005) Μια καλλιτεχνική εισαγωγή στα μελάνια ανθοκυανίνης. Science in School 31.
Institutions
Science on StageReview
Η Χημεία της οξειδοαναγωγής του μαγγανίου αποτελεί συναρπαστική πτυχή της χημείας των στοιχείων μετάπτωσης. Αυτή η απλή πρακτική άσκηση επιτρέπει στους μαθητές να εξοικειωθούν με τις διαφορετικές οξειδωτικές καταστάσεις του μαγγανίου και τα αντίστοιχα χρώματα.
Η παρατήρηση των διαφορετικών χρωμάτων θα προκαλέσει συζήτηση και θα αποτελέσει σημείο εστίασης προκειμένου να κατανοήσει κάποιος τι συμβαίνει στα οξειδοαναγωγικά στάδια της αντίδρασης.
Andrew Galea, Καθηγητής χημείας, Σχολείο δευτεροβάθμιας εκπαίδευσης Giovanni Curmi, Μάλτα





