Supporting materials
Αυτοθερμαινόμενα γεύματα: οξειδοαναγωγικές αντιδράσεις αδρανοποίηση και γαλβανικό στοιχείο (Word)
Download
Download this article as a PDF

Μετάφραση από την Παρασκευή Θάνου (Paraskevi Thanou). Επιθυμήσατε ποτέ ένα ζεστό ποτό ή γεύμα αλλά δεν είχατε φωτιά ή εστία κοντά σας; Η Marlene Rau παρουσιάζει δύο…

Τα αυτοθερμαινόμενα γεύματα – που αρχικά παρασκευάστηκαν για στρατιωτική χρήση- είναι έτοιμα αυτοθερμαινόμενα πακέτα γευμάτων. Μπορούν να θερμανθούν με πολλούς τρόπους – πιέζοντας ένα κουμπί στη συσκευασία, ξετυλίγοντας και ανακινώντας δυνατά το πακέτο ή χύνοντας το περιεχόμενο μιας σακούλας σε μια άλλη και περιμένοντας λίγα λεπτά – όλοι εκ των οποίων χρησιμοποιούν εξώθερμες χημικές αντιδράσεις. Αυτά τα γεύματα μπορούν να χρησιμοποιηθούν ως κίνητρο για τους μαθητές για να μελετήσουν τέτοιες αντιδράσεις με σχετική ασφάλεια και χωρίς τη χρήση ενός λύχνου ή θερμαντικής εστίας. Επιπλέον δίνεται η ευκαιρία για συζήτηση των αρνητικών οικολογικών επιπτώσεων των γευμάτων μιας χρήσης.
Για το επόμενο πείραμα, χρησιμοποιούμε το σύστημα του αυτοθερμαινόμενου γεύματος Crosse & Blackwell, το οποίο βασίζεται στην αντίδραση του μαγνησίου με αλατόνερο προς σχηματισμό υδρογόνου:

Mg (s) + 2H2O (l) -> Mg2+ (aq) + H2 (g) ↑ + 2OH- (aq)
s: στερεό, l: υγρό, g: αέριο, aq: ενυδατωμένο ιόν, το βέλος υποδηλώνει ότι ελευθερώνεται αέριο.
Αυτή η αντίδραση είναι πολύ αργή λόγω της αδρανοποίησης, κι έτσι για να επιταχυνθεί, προστίθενται σίδηρος και αλάτι. Αδρανοποίηση είναι η διεργασία, κατά την οποία ένα υλικό γίνεται λιγότερο δραστικό, συνήθως με την εναπόθεση μιας στιβάδας οξειδίου στην επιφάνειά του: αν εμβαπτίσετε μία λωρίδα μαγνησίου σε κρύο νερό, η επιφάνειά της θα οξειδωθεί προς υδροξείδιο του μαγνησίου (Mg(OH)2), και αυτή η επίστρωση θα εμποδίσει την περαιτέρω αντίδραση.
Επομένως, στο αυτοθερμαινόμενο γεύμα προστίθεται σίδηρος στο μαγνήσιο, οδηγώντας στο σχηματισμό ενός γαλβανικού στοιχείου – διάβρωση μικρής κλίμακας που συμβαίνει εκεί που δύο μέταλλα διαφορετικής δραστικότητας έρχονται σε επαφή κάτω από συνθήκες υγρασίας – ο οποίος (σχηματισμός) επιταχύνει την εξώθερμη αντίδραση. Επειδή το δυναμικό αναγωγής του μαγνησίου είναι μικρότερο από του σιδήρου (του λιγότερο δραστικού μετάλλου), ηλεκτρόνια θα περάσουν από το μαγνήσιο στο σίδηρο, και μόνο από εκεί στο http://www.scienceinschool.org/node/2376#overlay=node/2376/editνερό. Παρόλο που κατιόντα μαγνησίου (Mg2+) και ανιόντα υδροξειδίου (OH-) συνεχίζουν να σχηματίζονται, διαχωρίζονται από το σίδηρο και δεν μπορούν να ενωθούν για να σχηματίσουν υδροξείδιο του μαγνησίου. Ως αποτέλεσμα, το μαγνήσιο δεν αδρανοποιείται με επικάλυψη υδροξειδίου του μαγνησίου, η οποία θα μείωνε τη δραστικότητα.
Επειδή τα αντίθετα φορτισμένα ιόντα μαγνησίου και υδροξειδίου είναι ευκίνητα, σε καθαρό νερό θα σχημάτιζαν σύντομα υδροξείδιο του μαγνησίου, το φορτίο θα είχε εξισορροπηθεί και η αντίδραση θα επιβραδυνόταν πάλι. Για να προληφθεί αυτό, προστίθεται χλωριούχο νάτριο στο νερό, ώστε τα προερχόμενα από το αλάτι ιόντα νατρίου (Na+) και χλωρίου (Cl-) να κινηθούν προς τα ιόντα μαγνησίου και υδροξειδίου, εξισορροπώντας το φορτίο.
Το πείραμα μπορεί να χρησιμοποιηθεί για να εισαχθούν και να συζητηθούν τα θέματα της μεταφοράς ηλεκτρονίων, του γαλβανικού στοιχείου, της αδρανοποίησης, της θυσιαστικής ανόδου, της διάβρωσης και της σύνθεσης του νερού (ομοιοπολικοί δεσμοί, πολικότητα και αριθμοί οξείδωσης). Χρειάζονται περίπου 45 λεπτά συν το χρόνο συζήτησης και έχει δοκιμαστεί επιτυχώς με παιδιά 14 ετών για τη μελέτη αντιδράσεων μεταφοράς ηλεκτρονίων και διάβρωσης, όπως και με μεγαλύτερους μαθητές για εργασία στην ηλεκτροχημεία.
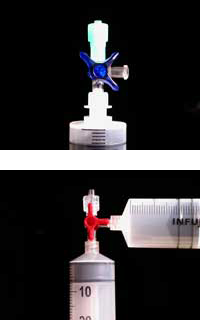
Τα πλαστικά υλικά που απαιτούνται για το πείραμα μπορούν να παραγγελθούν ως μέρος των έτοιμων ChemZw2 kits, που αναπτύχθηκαν σε συνεργασία με το πρόγραμμα Lebensnaher Chemieunterricht (LNCU)w3, αλλά είναι επίσης διαθέσιμα από τους περισσότερους προμηθευτές ιατρικών και χημικών εργαστηρίων.
Σημείωση: αν χρησιμοποιήσετε το περιεχόμενο μόνο των δύο από τα τέσσερα πακέτα μιγμάτων μαγνησίου / σιδήρου, μπορείτε να κρατήσετε το περιεχόμενο των άλλων δύο για τα πειράματα των μαθητών – αρκεί για περίπου 20 ομάδες μαθητών. Ακόμη και με τις δύο μόνο συσκευασίες για την επίδειξη, το αυτοθερμαινόμενο γεύμα θα φτάσει τη θερμοκρασία των 100 °C μετά από ένα περίπου λεπτό.
Στο γαλβανικό στοιχείο παράγεται υδροξείδιο του μαγνησίου. Αν είναι επιθυμητό, αυτό μπορεί να ανιχνευθεί χρησιμοποιώντας φαινολοφθαλεΐνη (βλ. παρακάτω).
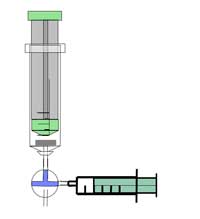
Σημείωση ασφαλείας: Φορέστε γυαλιά ασφαλείας. Η αντίδραση παράγει πολύ εύφλεκτο αέριο – προσέχετε. Δείτε επίσης τη γενική σημείωση ασφαλείας
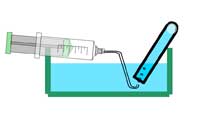
Προαιρετικά: προσθέστε μια σταγόνα διαλύματος φαινολοφθαλεΐνης στο νερό που συλλέξατε στο ποτήρι ζέσεως. Τι συμβαίνει; Γιατί;
Σημείωση υγιεινής και ασφάλειας: τα εναπομείναντα υγρά μπορούν να αποχυθούν στο νεροχύτη. Καθαρίστε τα πλαστικά υλικά με νερό και αφήστε τα να στεγνώσουν.
Άλλες αντιδράσεις που χρησιμοποιούνται συνήθως στα αυτοθερμαινόμενα γεύματα περιλαμβάνουν την οξείδωση του σιδήρου, την αντίδραση του άνυδρου χλωριούχου ασβεστίου με το νερό (βλ. παρακάτω) ή, για ψύξη, την αντίδραση του λιπάσματος νιτρικού αμμωνίου με το νερό.
Περαιτέρω πειράματα, όπως η παρασκευή αυτοθερμαινόμενων ή αυτοψυχόμενων πακέτων, ή ο προσδιορισμός της περιεκτικότητας του αέρα σε οξυγόνο με τη βοήθεια της αντίδρασης οξείδωσης του σιδήρου που χρησιμοποιείται στα αυτοθερμαινόμενα πακέτα, περιγράφονται στην ιστοσελίδα του LNCUw3.
Αυτή η δραστηριότητα μπορεί να αποτελέσει επίσης μέρος ενός μαθήματος, στο οποίο οι μαθητές αναπτύσσουν ένα σενάριο για ένα τηλεοπτικό επιστημονικό πρόγραμμα, ώστε να απαντήσουν σε ερώτηση τηλεθεατή σχετικά με τη λειτουργία των αυτοθερμαινόμενων γευμάτων. Η ελληνική έκδοση αυτού του φύλλου εργασίας είναι διαθέσιμη στην ιστοσελίδα του Science in Schoolw5, ενώ η γερμανική στην ιστοσελίδα του LNCUw3.
Σε αυτή τη δραστηριότητα, οι μαθητές θερμαίνουν καφέ χρησιμοποιώντας άνυδρο χλωριούχο ασβέστιο και νερό. Η δραστηριότητα λειτουργεί με επιτυχία και ως μέρος μιας διδακτικής ενότητας στη διάλυση αλάτων στο νερό, για να εισάγει την ενεργειακή πλευρά αυτής της διεργασίας. Οι μαθητές θα πρέπει να είναι ήδη εξοικειωμένοι με τους ιοντικούς και τους ομοιοπολικούς δεσμούς. Η δραστηριότητα λειτουργεί με επιτυχία με ομάδες των τριών μαθητών ηλικίας 14 ετών και άνω.
Μια πιθανότητα είναι να συζητηθεί η ενέργεια πλέγματος, χρησιμοποιώντας ως παράδειγμα από την καθημερινή ζωή τα αυτοψυχόμενα πακέτα που βασίζονται σε μια ενδόθερμη αντίδραση, η οποία ενεργοποιείται λυγίζοντας ένα μεταλλικό έλασμα. Η παρακάτω δραστηριότητα μπορεί στη συνέχεια να χρησιμοποιηθεί για να εισάγει την έννοια της ενέργειας ενυδάτωσης και να δείξει ότι η αντίδραση κατά την οποία διαλύονται ορισμένα άλατα είναι εξώθερμη διεργασία.
Η δραστηριότητα είναι σχετικά ασφαλής – η πιο επικίνδυνη πλευρά είναι η πιθανότητα να σπάσει το γυαλί, αν δεν το χειριστείτε σωστά.
Σημείωση ασφαλείας: Φορέστε γυαλιά ασφαλείας, μην πίνετε τον καφέ.
Δύο προβλήματα που συνήθως αντιμετωπίζουν οι μαθητές είναι ότι προσθέτουν πολύ λίγο χλωριούχο ασβεστίο στο νερό (όσο περισσότερο χρησιμοποιούν, τόσο περισσότερη θερμότητα παράγεται) και ότι ξεχνούν να μονώσουν τα ποτήρια τους.
Μια κοινή λύση στο πρόβλημα είναι να φτιάξουν ένα αυτοσχέδιο μικρό υδρόλουτρο, τοποθετώντας νερό και χλωριούχο ασβέστιο σε ένα μεγάλο ποτήρι ζέσεως και στερεώνοντας αφρώδες πολυστυρένιο γύρω από το ποτήρι με μια κολλητική ταινία. Ο καφές μπορεί να θερμανθεί τότε σε ένα μικρότερο ποτήρι ζέσεως στο αυτοσχέδιο υδρόλουτρο.
Το καλύτερο αποτέλεσμα στα πλαίσια του προγράμματος LNCU (βλ. πλαίσιο) επιτεύχθηκε γεμίζοντας ένα μικρό ποτήρι ζέσεως με νερό και τοποθετώντας το σε ένα μεγαλύτερο ποτήρι με μια στιβάδα από αφρώδες πολυστυρένιο ενδιάμεσα για θερμομόνωση. Οι μαθητές στη συνέχεια τοποθέτησαν το χλωριούχο ασβέστιο, στο οποίο είχαν προσθέσει πολύ λίγο νερό, σε ένα μικρό κουτί φωτογραφικού φιλμ. Προσδένοντας σε αυτό ένα σκοινί και μια πέτρα ως βαρίδιο, το άφησαν να αιωρείται μέσα στο νερό. Η θερμοκρασία των 50 ml καφέ μεταβλήθηκε από τους 20 στους 44 °C σε λιγότερο από ένα λεπτό.
Συζητήστε την προφανή αντίθεση μεταξύ της συμπεριφοράς των αυτοψυχόμενων πακέτων στα προηγούμενα πειράματα και του πειράματος που μόλις εκτελέσατε – σε αυτή την περίπτωση, η διεργασία της διάλυσης δεν είναι ενδόθερμη. Στα αυτοψυχόμενα πακέτα, απαιτείται περισσότερη ενέργεια για να καταστραφεί το κρυσταλλικό πλέγμα του άλατος (ενέργεια πλέγματος) από την ενέργεια που απελευθερώνεται, όταν τα μόρια του νερού περιβάλλουν τα ιόντα (ενέργεια ενυδάτωσης). Η απαιτούμενη ενέργεια απορροφάται από το περιβάλλον, οπότε το διάλυμα ψύχεται. Αντίθετα, στο πείραμα με τον καφέ η ενέργεια ενυδάτωσης είναι μεγαλύτερη από την ενέργεια πλέγματος, οπότε η διεργασία στο σύνολό της είναι εξώθερμη. Η ενέργεια ενυδάτωσης και η ενέργεια πλέγματος είναι σταθερά χαρακτηριστικά του κάθε άλατος.
Ως συνέχεια, οι μαθητές θα μπορούσαν να προσπαθήσουν να επιτύχουν τη χαμηλότερη δυνατή θερμοκρασία χρησιμοποιώντας άνυδρο χλωριούχο ασβέστιο, χλωριούχο νάτριο και πάγο. Ίσως εκπλαγούν, όταν ανακαλύψουν ότι η προσθήκη του άνυδρου χλωριούχου ασβεστίου στον πάγο (σε αντίθεση με το νερό) δεν αυξάνει τη θερμοκρασία. Αυτό συμβαίνει, επειδή οι δεσμοί υδρογόνου στους κρυστάλλους του πάγου πρέπει πρώτα να διασπαστούν, το οποίο απαιτεί ενέργεια, με αποτέλεσμα η όλη διεργασία να είναι ενδόθερμη.
Το 2003 τέσσερις Γερμανοί καθηγητές χημείας ένωσαν τις δυνάμεις τους για να δημιουργήσουν μια διαδικτυακή πύλη για να μοιραστούν τις καλύτερες ιδέες διδασκαλίας τους: το Lebensnaher Chemieunterrichtw3 (LNCU, μαθήματα χημείας σχετιζόμενα με την καθημερινή ζωή). Η συλλογή τους αυξήθηκε σταθερά, και προσφέρουν μια ευρεία ποικιλία δραστηριοτήτων για όλες τις ηλικίες από την πρωτοβάθμια μέχρι την ανώτερη δευτεροβάθμια εκπαίδευση, σχετικές με τα σημαντικότερα θέματα της διδακτέας ύλης στη χημεία, όπως ο περιοδικός πίνακας, η τιτλοδότηση, ο αέρας και το νερό, καθώς και επιπλέον δραστηριότητες βιολογίας και φυσικής για τους πιο μικρούς μαθητές.
Το γερμανόγλωσσο υλικό τους είναι διαθέσιμο ελεύθερα ως μεταφορτώσιμα αρχεία PDF και έγγραφα Word®, τόσο με οδηγίες για τους δασκάλους όσο και με φύλλα εργασίας των μαθητών. Επιπλέον, η ιστοσελίδα προσφέρει μια ποικιλία από videos σχετικά με τις δραστηριότητες και μια λίστα περισσότερων ιστοσελίδων (γερμανικών και αγγλικών) με ιδέες διδασκαλίας και σχετικό υλικό για τα μαθήματα των Φυσικών Επιστημών.
Μπορείτε να βρείτε επίσης μια φωτογραφική παρουσίαση του πώς παρασκευάζονται τα αυτοθερμαινόμενα γεύματα εδώ: www.mlaltd.co.uk/store
Kalogirou E, Nicas E (2010) Microscale chemistry: experiments for schools. Science in School 16: 27-32. www.scienceinschool.org/2010/issue16/microscale
Αυτό το άρθρο επιτρέπει στους μαθητές να ανακαλύψουν το σύνδεσμο μεταξύ της επιστήμης στην τάξη και του πραγματικού κόσμου. Με πειράματα που έχουν έναν ελκυστικό παράγοντα – που συχνά λείπει από τα πρακτικά μαθήματα – οι μαθητές μπορούν να αναπτύξουν και να κτίσουν ικανότητες και γνώση.
Το κύριο θέμα που παρουσιάζεται είναι η χημεία, αλλά ο δάσκαλος μπορεί να προσαρμόσει το μάθημα, ώστε να συμπεριλάβει συζητήσεις για την ενέργεια σχετικές και με άλλα θέματα, όπως για παράδειγμα η διατήρηση της υψηλής θερμοκρασίας, η επιβίωση σε ψυχρά κλίματα και η αντιμετώπιση τραυμάτων στον αθλητισμό. Τα πειράματα μπορούν επίσης να χρησιμοποιηθούν για να δώσουν το έναυσμα για συζήτηση του πώς λειτουργεί η επιστήμη.
Nick Parmar, Ηνωμένο Βασίλειο