Υπερνικώντας τα τεχνάσματα της γρίπης Understand article
Μετάφραση από την Παρασκευή Θάνου (Paraskevi Thanou). Το κυνήγι του ιού της γρίπης μπορεί να αποτελέσει κάτι περισσότερο από μια απλή ενόχληση: αυτά τα παθογόνα έχουν…
Η εικόνα προσφέρθηκε από
EMBL Photolab
Μοιάζει με μια διαρκή μάχη – μόλις έχετε κατεβάσει μια αναβάθμιση ασφαλείας για τον υπολογιστή σας, ένας χάκερ βρίσκει ένα άλλο αδύναμο σημείο. Για ακόμη μια φορά, το μηχάνημά σας είναι απροστάτευτο απέναντι στις επιθέσεις από ιούς, κατασκοπευτικά και άλλα κακόβουλα προγράμματα, μέχρι η επόμενη αναβάθμιση να διορθώσει το ψεγάδι.
Τα κύτταρα στο σώμα μας αντιμετωπίζουν παρόμοια προβλήματα: διαθέτουν κι αυτά μια πληθώρα μηχανισμών ασφαλείας, ώστε να εμποδίζουν τους ιούς να τα κυριεύουν. Αυτά τα συστήματα όμως δεν είναι τέλεια και πολλοί ιοί έχουν αναπτύξει ύπουλες στρατηγικές για να εισέρχονται στα κύτταρα. Μια ομάδα επιστημόνων από το πρόγραμμα FLUPOLw1 της Ευρωπαϊκής Ένωσης προσπαθεί να καταλάβει αυτές τις στρατηγικές, για να αναπτύξει μια αναβάθμιση ασφαλείας για το ανθρώπινο σώμα. Οι επιστήμονες αποσαφήνισαν μια από τις τακτικές που χρησιμοποιεί ο ιός της γρίπης, ανοίγοντας το δρόμο για νέα φάρμακα, ώστε να καταπολεμήσουν μελλοντικές πανδημίες γρίπης.
Η γρίπη αποτελεί σοβαρή ανησυχία για τις κυβερνήσεις και τους οργανισμούς υγείας σε ολόκληρο τον κόσμο. Παρόλο που τα κοινά στελέχη του ιού είναι σπάνια θανατηφόρα για τους υγιείς ανθρώπους, μπορούν να αποβούν μοιραία για τους ηλικιωμένους ή για αυτούς που πάσχουν από άλλες ασθένειες ή έχουν εξασθενημένο ανοσοποιητικό σύστημα. Όμως νέα στελέχη του ιού εξελίσσονται διαρκώς και μπορούν να αποδειχθούν πιο επικίνδυνα από τους προγόνους τους. Η πιο ανησυχητική απειλή όλων είναι το ενδεχόμενο, η γρίπη των πτηνών – ο ιός της γρίπης που μολύνει τα πτηνά – να αναπτύξει την ικανότητα να μολύνει εύκολα τους ανθρώπους. Στο παρελθόν, ιοί που κάνανε αυτό το «άλμα» υπήρξαν εξαιρετικά θανατηφόροι. Για παράδειγμα, το 1918 η πανδημία γρίπης (από τα ελληνικά, παν: όλος και δήμος: λαός, μια επιδημία μολυσματικής ασθένειας που εξαπλώνεται στον πληθυσμό μιας μεγάλης περιοχής, όπως είναι μια ήπειρος, ή ακόμη και παγκόσμια), που προερχόταν επίσης από τα πτηνά, προκάλεσε το θάνατο 50 έως 100 εκατομμυρίων ανθρώπων, καθώς εξαπλώθηκε σε όλο τον κόσμο. Ήταν η πιο θανατηφόρα πανδημία στην πρόσφατη ιστορία.
Τα προηγούμενα χρόνια, έχουν εκφραστεί φόβοι για ένα στέλεχος του ιού της γρίπης των πτηνών που ονομάζεται Η5Ν1 (βλ. επίσης Niekoop & Rienks, 2006), το οποίο έχει ήδη μολύνει και προκαλέσει το θάνατο σε μερικές εκατοντάδες ανθρώπους παγκοσμίως. Αν τελικά αποκτήσει την ικανότητα να μεταδίδεται από άνθρωπο σε άνθρωπο, θα μπορούσαμε να αντιμετωπίσουμε μια νέα θανατηφόρα πανδημία. Εμβόλια κατά της γρίπης υπάρχουν μεν, αλλά όσα δρουν εναντίον ενός στελέχους του ιού της γρίπης, συχνά έχουν περιορισμένη δράση εναντίον άλλων στελεχών. Εμβόλια κατά νέων στελεχών χρειάζονται πολύ χρόνο για να παραχθούν και, όταν είναι έτοιμα, μπορεί να είναι πολύ αργά για να περιοριστεί μια νέα πανδημία. Νέοι τρόποι να σταματήσουν την εξάπλωση του ιού είναι απόλυτα αναγκαίοι.
Όταν ο ιός της γρίπης μολύνει ένα κύτταρο-ξενιστή, ο στόχος του είναι να παράγει πολλά αντίγραφα του εαυτού του που συνεχίζουν να επιτίθενται σε ακόμη περισσότερα κύτταρα. Ένα ιικό ένζυμο αποτελούμενο από τρεις υπομονάδες, που ονομάζεται πολυμεράση, είναι το κλειδί γι’ αυτή τη διαδικασία. Αντιγράφει το γενετικό υλικό του ιού και κατευθύνει τη μηχανή του κυττάρου-ξενιστή στη σύνθεση ιικών πρωτεϊνών. Το κάνει αυτό μέσω μιας διαδικασίας, που είναι γνωστή ως «απόσπαση καλύμματος» (cap snatching) (βλ. εικόνα). Το κάλυμμα είναι ένα πρόσθετο μικρό κομμάτι RNA, το οποίο πρέπει να υπάρχει στην αρχή όλων των αγγελιοφόρων RNA (mRNA). Είναι απαραίτητο για να κατευθύνει την πρωτεϊνοσυνθετική μηχανή του κυττάρου στο σημείο έναρξης της πρωτεϊνοσύνθεσης, ώστε να μπορεί να συντεθεί μια νέα πρωτεΐνη σύμφωνα με την πληροφορία που περιέχεται στο mRNA.
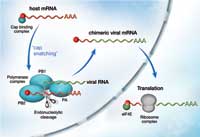
το κάλυμμα του mRNA του ξενιστή
με τη βοήθεια της πρωτεΐνης PB2,
που αποτελεί μέρος του
συμπλέγματος της πολυμεράσης.
Με το κάλυμμα προσαρτημένο,
το RNA του ιού μπορεί να
μεταφραστεί σε πρωτεΐνες από τα
ριβοσώματα στο κυτταρόπλασμα
και παράγονται περισσότερα
αντίγραφα του ιού Κάντε κλικ
στην εικόνα για μεγέθυνση
Η εικόνα προσφέρθηκε
από Petra Riedinger
Η ιική πολυμεράση κλέβει το κάλυμμα από τα μόρια RNA του κυττάρου-ξενιστή: συνδέεται στο mRNA του κυττάρου-ξενιστή μέσω του καλύμματος, αποκόπτει το κάλυμμα και το προσθέτει στην αρχή του mRNA του ίδιου του ιού. Αλλά πώς ακριβώς η πολυμεράση το επιτυγχάνει αυτό, και τι κάνει η καθεμιά από τις τρεις υπομονάδες, παραμένει αμφιλεγόμενο. Η βιοχημεία της ιικής πολυμεράσης είναι πιθανώς πολύ διαφορετική από αυτή των ανθρώπινων πρωτεϊνών, πράγμα που κάνει την πολυμεράση έναν ελκυστικό στόχο για φάρμακα, τα οποία στοχεύουν στη μείωση της εξάπλωσης της μόλυνσης στο σώμα, αφού αυτή η διαφορά μειώνει τον κίνδυνο της βλάβης των ανθρώπινων πρωτεϊνών ως παρενέργειας.
Επιπλέον, η γνώση σχετικά με την πολυμεράση είναι σημαντική για την κατανόηση του πώς μεταδίδεται η γρίπη ανάμεσα στα διάφορα είδη. Αρκετές από τις μεταλλάξεις που επιτρέπουν στον ιό της γρίπης των πτηνών να προσαρμοστεί στη ζωή σε έναν άνθρωπο-ξενιστή εμφανίζονται στην πρωτεϊνική αλυσίδα της πολυμεράσης, οπότε είναι βασικό να μάθουμε τι κάνουν. Αυτό δεν είναι καθόλου εύκολο και απαιτεί μεγάλο εύρος εξειδικευμένης γνώσης. Το πρόγραμμα FLUPOL της Ευρωπαϊκής Ένωσης αναπτύχθηκε για να αντιμετωπίσει αυτή την πρόκληση: οι ομάδες των Stephen Cusack και Darren Hart στο εργαστήριο EMBL στη Γκρενόμπλw2, Γαλλία, σε συνεργασία με επιστήμονες από τη Μονάδα Αλληλεπιδράσεων Ιού και Κυττάρου Ξενιστή στη Γκρενόμπλ (Unit of Virus Host Cell Interactions)w3, ένωσαν τις δυνάμεις τους με άλλες ευρωπαϊκές ομάδες στη Μαδρίτη, τη Λυών, το Λονδίνο και το Μάρμπουργκ. «Έχουμε μια διαθεματική προσέγγιση στη μελέτη αυτού του ενζύμου, από τη βιοπληροφορική μέσω της δομής έως μοντέλα ποντικών για τη μετάδοση ανάμεσα στα είδη,» αναφέρει ο Stephen.
Η πολυμεράση, ωστόσο, δεν αποκαλύπτει εύκολα τα μυστικά της. Για πολλά χρόνια, ήταν αδύνατο να πάρουμε οποιαδήποτε πληροφορία για την τρισδιάστατη δομή της. Για να το κατορθώσουν αυτό, οι ερευνητές πρέπει να παράγουν τις πρωτεΐνες που απαρτίζουν την πολυμεράση σε διαλυτή μορφή και να τις κρυσταλλώσουν. Με έκθεση των κρυστάλλων σε ακτινοβολία Χ, είναι ικανοί να βγάλουν συμπεράσματα για τη δομή αυτών των πρωτεϊνών και να καταλάβουν καλύτερα πώς λειτουργούν. Για μια εισαγωγή στην κρυσταλλογραφία, βλ. το άρθρο της Dominique Cornuéjols σε αυτό το τεύχος. Μπορείτε επίσης να δοκιμάσετε να κρυσταλλώσετε πρωτεΐνες στην τάξη (Blattmann & Sticher 2009).
Για μεγάλο διάστημα, κανένας δεν κατάφερε να αποκτήσει τους σημαντικούς κρυστάλλους. Όποτε το προσπαθούσαν, οι ερευνητές έβρισκαν ότι οι πρωτεΐνες είτε σχημάτιζαν άχρηστα αδιάλυτα αθροίσματα είτε δεν μπορούσαν να παράγουν αρκετή ποσότητα ευδιάλυτης πρωτεΐνης για να εργαστούν. Δυστυχώς, οι επιστήμονες δεν μπόρεσαν να καταφύγουν στη συνήθη στρατηγική τους, για να λύσουν αυτό το πρόβλημα: να τεμαχίσουν τις πρωτεΐνες στα επιμέρους λειτουργικά τους μέρη, που ονομάζονται περιοχές, με την ελπίδα ότι αυτά θα είναι διαλυτά. Αυτή η μέθοδος βασίζεται στην αναγνώριση των περιοχών προκαταβολικά. Οι βιολόγοι συνήθως το κάνουν αυτό συγκρίνοντας την αλληλουχία των αμινοξέων της πρωτεΐνης-στόχου με την αντίστοιχη άλλων πρωτεϊνών, των οποίων η δομή είναι γνωστή. Όμως η πολυμεράση του ιού της γρίπης είναι διαφορετική από οποιαδήποτε γνωστή πρωτεΐνη, κι έτσι μια τέτοια προσέγγιση ήταν αδύνατη.

Η εικόνα προσφέρθηκε από EMBL
Photolab
Η λύση ήρθε με τη μορφή ενός νέου αυτοματοποιημένου συστήματος που ανακάλυψε ο Darren. Ονομάζεται ESPRIT (Expression of Soluble Proteins by Random Incremental Truncation, Έκφραση Διαλυτών Πρωτεϊνών με Τυχαία Αυξητική Αποκοπή) και αυτό το σύστημα επιτρέπει στους επιστήμονες να ελέγξουν γρήγορα και εύκολα όλα τα πιθανά τμήματα μιας πρωτεΐνης για κατάλληλες διαλυτές περιοχές.
Το 2007, οι Darren και Stephen χρησιμοποίησαν το ESPRIT για να ανακτήσουν το πρώτο διαλυτό τμήμα της ΡΒ2, μιας από τις τρεις υπομονάδες (PA, PB1, PB2) που ενώνονται για να σχηματίσουν την πολυμεράση του ιού της γρίπης (Tarendeau et al., 2007). Έχοντας προσδιορίσει τη δομή αυτού του τμήματος, ανακάλυψαν πώς βοηθάει την υπομονάδα ΡΒ2 να μεταφερθεί στον πυρήνα του κυττάρου-ξενιστή, όπου ενώνεται με τις άλλες δύο υπομονάδες για να σχηματίσουν τη λειτουργική πολυμεράση.
Οι Stephen και Darren ενδιαφέρονταν κυρίως για μια άλλη περιοχή της ΡΒ2 που παίζει έναν καθοριστικό ρόλο στην απόσπαση του καλύμματος. Η υπομονάδα ΡΒ2 συνδέεται στο mRNA του κυττάρου-ξενιστή μέσω του καλύμματος, και η υπομονάδα ΡΒ1 της πολυμεράσης αποκόπτει το κάλυμμα και το προσαρτεί στην αρχή του ιικού mRNA. Το ιικό mRNA, με προσαρτημένο το κάλυμμα, μπορεί στη συνέχεια να αναγνωριστεί από τη μηχανή του κυττάρου-ξενιστή, επιτρέποντας στις ιικές πρωτεΐνες να συντεθούν σε βάρος των πρωτεϊνών του κυττάρου-ξενιστή. Χωρίς το κάλυμμα, ένα μόριο mRNA δεν μπορεί να μεταφραστεί σε πρωτεΐνη. Έτσι, φάρμακα που αναστέλλουν την ενεργότητα πρόσδεσης της ΡΒ2 στο κάλυμμα θα μπορούσαν να σταματήσουν την αναπαραγωγή του ιού της γρίπης.
Μέχρι τώρα, ωστόσο, λίγα ήταν γνωστά για το πώς λειτουργεί η ΡΒ2. «Αυτό μελετήθηκε για πολλά χρόνια, αλλά κανένας δεν ήταν σίγουρος για το πού ακριβώς βρισκόταν η περιοχή όπου προσδένεται το κάλυμμα,» αναφέρει ο Stephen.
Χάρη στο ESPRIT, οι Darren, Stephen και οι συνεργάτες τους βρήκαν ένα τμήμα της ΡΒ2 που προσδενόταν στο κάλυμμα. Με τη βοήθεια της μονάδας κρυστάλλωσης υψηλής απόδοσης στο EMBL στη Γκρενόμπλ και των δεσμών ακτινοβολίας Χ μεγάλης έντασης του συγχρότρου στο European Synchrotron Radiation Facility (ESRF)w4 (βλ. Cornuéjols, 2009), καθόρισαν τη δομή της περιοχής πρόσδεσης της ΡΒ2, όταν αυτή έχει προσδεθεί στο κάλυμμα. Αυτό αποκάλυψε ότι η περιοχή περιείχε μια δομή που δεν είχε εμφανιστεί ξανά. «Είναι εντελώς διαφορετική στην αναδίπλωσή της από οποιαδήποτε άλλη πρωτεΐνη,» αναφέρει ο Stephen.
Αλλά, παρόλο που η δομή ήταν εντελώς καινούργια, ο τρόπος με τον οποίο η περιοχή αλληλεπιδρούσε με το κάλυμμα, είχε την ίδια βασική ιδέα, όπως και για άλλες πρωτεΐνες που προσδένονται σε κάλυμμα: η κεντρική αλληλεπίδραση είναι ένα «σάντουιτς» με δύο αμινοξέα της ΡΒ2 να περικλείουν την κάθε πλευρά του καλύμματος (βλ. εικόνα). «Είναι ένα ωραίο παράδειγμα συγκλίνουσας εξέλιξης, όπου πρωτεΐνες εντελώς διαφορετικής προέλευσης βρίσκουν την ίδια λύση,» αναφέρει ο Darren.
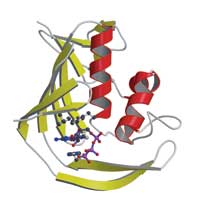
της πρωτεΐνης ΡΒ2 του ιού της
γρίπης δείχνει πώς ο ιός κλέβει
ένα μόριο «καλύμματος» από
τον ξενιστή. Η ΡΒ2 συνδέεται
στο κάλυμμα (επισημασμένο)
περικλείοντάς το μεταξύ
αρωματικών αμινοξέων.
Κάντε κλικ στην εικόνα
για μεγέθυνση
Η εικόνα προσφέρθηκε
από Petra Riedinger
Για να αποδείξουν ότι το συγκεκριμένο τμήμα ήταν πράγματι ο ένοχος κλέφτης του καλύμματος, οι Darren και Stephen δημιούργησαν τμήματα που περιείχαν μεταλλάξεις των αμινοξέων που περικλείουν το κάλυμμα. Με βεβαιότητα τα περισσότερα από τα τμήματα με τις μεταλλάξεις δεν αλληλεπίδρασαν με το κάλυμμα. Επιπλέον, όπως έδειξαν οι ερευνητές του FLUPOL στο Εθνικό Κέντρο Βιοτεχνολογίας στη Μαδρίτη (Centro Nacional de Biotecnologia)w5, οι ίδιες μεταλλάξεις παρεμπόδισαν την ικανότητα ολόκληρης της πολυμεράσης να συνθέτει νέους ιούς. «Μπορέσαμε να δείξουμε τη σημασία αυτού του γεγονότος για τον ιό στο σύνολό του,» αναφέρει ο Stephen (Guilligay et al., 2008).
Τώρα που η δομή είναι γνωστή, οι επιστήμονες μπορούν να τη χρησιμοποιήσουν για να σχεδιάσουν σχετικά απλά και μικρά μόρια που αναστέλλουν τη δράση της ΡΒ2. «Αν μπορείς να αναστείλεις την απόσπαση του καλύμματος, μπορείς να σκοτώσεις τον ιό,» λέει ο Stephen. Ο ίδιος και ο Darren προετοιμάζονται τώρα να ψάξουν για πιθανά φάρμακα που θα κάνουν ακριβώς αυτό. Χρησιμοποιούν τη δομή για να σχεδιάσουν έναν αναστολέα, αλλά εκμεταλλεύονται επίσης τη δυνατότητά τους να παράγουν μεγάλες ποσότητες του τμήματος της ΡΒ2, ώστε να ψάξουν τεράστιες συλλογές χημικών ουσιών για άλλα μόρια που προσδένονται στην ΡΒ2 – πιθανοί αναστολείς της ΡΒ2. «Είμαστε οι πρώτοι που μπορέσαμε να συνθέσουμε αρκετή ποσότητα αυτού του τμήματος, ώστε να εφαρμόσουμε την τακτική της εξαντλητικής δοκιμής, για να αναγνωρίσουμε μικρά μόρια αναστολέων,» αναφέρει ο Darren.
Πρόσφατα, ερευνητές στη UVHCI και στην ομάδα του Stephen ανακάλυψαν ότι μέρος της υπομονάδας ΡΑ, της τρίτης υπομονάδας της ιικής πολυμεράσης, είναι υπεύθυνο για την αποκοπή του καλύμματος του mRNA του ξενιστή (Dias et al., 2009). Τα αποτελέσματα προκάλεσαν μεγάλη έκπληξη, γιατί όλοι πίστευαν ότι η ενεργότητα της αποκοπής βρίσκεται σε άλλο μέρος της πολυμεράσης. Έτσι, με την ΡΑ βρέθηκε ακόμη ένα υποσχόμενο αντιικό φάρμακο-στόχος.
Οι ερευνητές συνέθεσαν κρυστάλλους της σημαντικής περιοχής της ΡΑ και τους εξέτασαν με τις δέσμες ακτίνων Χ μεγάλης ισχύος του ESRF στη Γκρενόμπλ. Οι εικόνες υψηλής ευκρίνειας που πήραν αποκαλύπτουν τα μεμονωμένα αμινοξέα που απαρτίζουν το ενεργό κέντρο, το οποίο είναι υπεύθυνο για την αποκοπή του καλύμματος από το RNA. Μια σχισμή στο κέντρο της περιοχής της ΡΑ παγιδεύει τη μακριά αλυσίδα του RNA, και τα σύμπλοκα μετάλλων στις άκρες της σχισμής απομακρύνουν το κάλυμμα. Περαιτέρω πειράματα στο ESRF επιβεβαίωσαν ότι αυτά τα σύμπλοκα μετάλλων περιέχουν μαγγάνιο, παρέχοντας μια σημαντική βοήθεια για την ανάπτυξη φαρμάκων, αφού θα είναι βασικό να λάβει υπόψη του κανείς τα μεταλλικά ιόντα για να σχεδιάσει βελτιωμένους αναστολείς. Το τέχνασμα θα είναι να εκμεταλλευτούμε τη γνώση σχετικά με τη δομή των ενεργών κέντρων της υπομονάδας της ιικής πολυμεράσης – που είτε είναι υπεύθυνα για την πρόσδεση των υποκαταστατών είτε εμφανίζουν ενζυμική ενεργότητα – για να σχεδιάσουμε μικρά μόρια-αναστολείς που μπορούν εξειδικευμένα να μπλοκάρουν τα κέντρα και επομένως τον πολλαπλασιασμό του ιού.
Τα ευρήματά τους έδωσαν στους επιστήμονες μια κοντινή και ολοκληρωμένη εικόνα του μηχανισμού της απόσπασης του καλύμματος και οι ερευνητές βρίσκονται τώρα στη διαδικασία της χρήσης του ESPRIT, για να αποκρυπτογραφήσουν τη δομή των υπολοίπων τμημάτων της πολυμεράσης του ιού της γρίπης, με την ελπίδα ότι στο άμεσο μέλλον θα ανακαλύψουν νέους τρόπους αντιμετώπισης των πονηρών τεχνασμάτων του ιού της γρίπης.
References
- Blattmann B, Sticher P (2009) Growing crystals from protein. Science in School 11: 30-36. www.scienceinschool.org/2009/issue11/lysozyme
- Cornuéjols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76. www.scienceinschool.org/2009/issue11/crystallography
- Dias A, Bouvier D, Crépin T, McCarthy AA, Hart DJ, Baudin F, Cusack S, Ruigrok RW (2009) The cap-snatching endonuclease of influenza virus polymerase resides in the PA subunit. Nature 458: 914-918. doi: 10.1038/nature07745. Κατεβάστε το άρθρο δωρεάν εδώ ή γραφτείτε συνδρομητές στο Nature σήμερα: www.nature.com/subscribe
- Guilligay D Tarendeau F, Resa-Infante P, Coloma R, Crepin T, Sehr P, Lewis J, Ruigrok RW, Ortin J, Hart DJ, Cusack S (2008) The structural basis for cap-binding by influenza virus polymerase subunit PB2. Nature Structural and Molecular Biology 15(5): 500-106. doi: 10.1038/nsmb.1421
- Niekoop L, Rienks F (2006) The ecologist’s view of bird flu. Science in School 3: 24-30. www.scienceinschool.org/2006/issue3/birdflu
- Tarendeau F, Boudet J, Guilligay D, Mas PJ, Bougault CM, Boulo S, Baudin F, Ruigrok RW, Daigle N, Ellenberg J, Cusack S, Simorre JP, Hart DJ (2007) Structure and nuclear import function of the C-terminal domain of influenza virus polymerase PB2 subunit. Nature Structural and Molecular Biology 14(3): 229-33. doi: 10.1038/nsmb1212
Web References
- w1 – Για περισσότερες πληροφορίες για το πρόγραμμα FLUPOL της Ευρωπαϊκής Ένωσης, δείτε: www.flupol.eu
- w2 – Μπορείτε να βρείτε την ιστοσελίδα του σταθμού του European Molecular Biology Laboratory (EMBL) στη Γκρενόμπλ εδώ: www.embl.fr
- w3 – Για να μάθετε περισσότερα για τη Μονάδα Αλληλεπιδράσεων Ιού και Κυττάρου Ξενιστή (Unit of Virus Host Cell Interactions) στη Γκρενόμπλ, δείτε: www.uvhci.fr
- w4 – Για περισσότερες πληροφορίες για το European Synchrotron Radiation Facility (ESRF) στη Γκρενόμπλ, δείτε: www.esrf.eu
- w5 – Για να μάθετε περισσότερα για το Εθνικό Κέντρο Βιοτεχνολογίας (Centro Nacional de Biotecnologia) στη Μαδρίτη, δείτε: www.cnb.uam.es





