Undersøgelse af enzymet ureases virkning Teach article
Oversat af Lene Hedegaard Jensen. Anna Lorenc fra Volvox projekt forklarer hvor man finder enzymet urease og hvorfor det er så vigtigt. Desuden præsenteres en øvelse, der kan benyttes til at demonstrere urease-aktiviteten i undervisningen.
Enzymer spiller en vigtig rolle i alle organismers stofskifte. De katalyserer og kontrollerer de fleste biokemiske reaktioner i vores krop – lige fra replikation af genetisk information (DNA polymerase) til fordøjelsen af mad. Det er dog ikke altid let at vise enzymets virkning. Der beskrives her et enkelt og billigt forsøg, som kan benyttes i forbindelse med undervisning omkring enzymers virkning. Alle materialer der benyttes er ufarlige og lette at anskaffe.
I denne undersøgelse benyttes enzym fra soyabønner (Glycine max). Urease spalter urinstof (carbamid) til ammoniak og carbondioxid:
CO(NH2)2 + H2O → 2 NH3 + CO2
i opløsning har høj pH, denne kan måles ved at benytte en simpel pH-indikator, som man f.eks. kan isolere fra rødkål. Desuden kan man også lugte at der bliver dannet ammoniak.
Da urease findes i mange forskellige organismer, kan denne øvelse benyttes i forbindelse med undervisningen i:
- Kvælstofs kredsløb
- Organismers påvirkning på deres omgivelser
- Dyrs tilpasning til forskellige kostsammensætninger.
Baggrund for øvelsen
Hvad er urinstof?
Alle organismer nedbryder aminosyrer og proteiner. Da disse indeholder nitrogen, vil der dannes nitrogenholdige affaldsprodukter ved nedbrydningen.
Pattedyr, padder og nogle hvirvelløse dyr udskiller nitrogenholdige affaldsstoffer, som for eksempel urinstof, der bliver dannet i leveren. Ved udskillelsen af nitrogen er urinstof en udmærket forbindelse, fordi det er vandopløseligt og mindre giftigt end ammoniak. I fisk udskilles nitrogen dog i form af ammoniak. Menneskets urin indeholder 2% urinstof.
Urinstof var den første organiske forbindelse, der blev syntetiseret. Friedrich Wöhler fremstillede i 1828 urinstof fra to uorganiske forbindelser (blycyanat, Pb(CN)2 og ammoniumhydroxid, NH4OH). Dette var banebrydende, idet man indtil da mente at organiske forbindelser kun kunne dannes i levende organismer. Desuden var det holdningen at det krævedes en speciel ‘vital kraft’ for at danne organiske forbindelser. Wöhler byggede med syntesen af urinstof bro mellem den levende og ikke-levende verden. Han fik ikke Nobelprisen for opdagelsen, fordi Nobelprisen ikke fandtes på den tid. I dag fremstilles urinstof i meget store mængder, det benyttes i plastikfremstilling og som billig kvælstofholdig gødning.
Hvad er urease?
Urease katalyserer hydrolysen af urinstof til carbondioxid og ammoniak. Urease findes fortrinsvis i frø, mikroorganismer og i hvirvelløse dyr. I planter findes urease som en hexamer – den består af seks identiske kæder – og findes i cytoplasmaet. I bakterier samles ureasen enten af to eller tre forskellige subunits. Aktivering af enzymet sker binding ved af to nikkel-ioner pr. subunit.
Hvordan blev urease berømt?
Det første enzym der blev isoleret og krystalliseret var urease fra jackbønner (Canavalia ensiformis). Dette blev udført af James B. Sumner i 1926, på et tidspunkt hvor de fleste videnskabsfolk mente, at det var umuligt at krystallisere enzymer. I 1946 fik Sumner Nobelprisen i kemi for dette arbejde. I dag benyttes krystallisation til at hjælpe med at finde strukturen og virkningsmekanismen for proteiner. Viden om struktur muliggør design af forbindelser der kan påvirke enzymets virkning; som for eksempel AIDS-medicin, som inhiberer virkningen af HIV-enzymerne eller i den seneste forskning i behandling mod rabies (Ainsworth, 2008).
Hvor finder man ellers urease?

Billede: iStockphoto
Mange arter bakterier producerer urease, blandt andet Helicobacter pylori, den bakterie der forårsager mavesår. Når ureasen dannes af H. pylori (og virker) hæves pH-værdien i mavesyren fra ca. pH 3 til pH 7, som er den optimale pH værdi for vækst af bakterien. Der findes en test for H. pylori, der benyttes til at dianogstisere mavesår. I denne test undersøger man udåndingsluften for urease.
Drøvtyggere (som køer og får) har en bakterie der fordøjer cellulose i den første del af deres maver (rumen). Disse bakterier hjælper dem med at fordøje planterne de spiser. Drøvtyggere udskiller desuden urinstof til denne del af deres mave, idet urinstof er en kilde til den nitrogen, som bakterien skal bruge for vækst. For at optage nitrogen udskiller bakterierne urease for at nedbryde urinstoffet. Endelig fordøjer dyrene bakteriemassen.
Er urease i soyabønner skadeligt for mennesker?
Urease er ikke skadeligt. Rå soyabønner indeholder dog andre forbindelser der er usunde. For eksempel er der en proteininhibitor i rå soyabønner, som forhindrer fordøjelsesenzymet trypsin i at virke, hvilket gør rå soyabønner ufordøjelige. Det er ikke let at detektere inhibitoren, men den har den samme varmefølsomhed som urease – begge kan inaktiveres ved opvarmning. Derfor bliver produkter fra soyabønner (soyamel eller soyaholdige madvarer, som tofu og tempe) testet for urease-aktivitet, for at sikre at inhibitoren også er inaktiv. Testen minder meget om den, der er beskrevet nedenfor. Hvis der ikke kan detekteres nogen urease-aktivitet, antages det at inhibitoren også er inaktiv.
Urease i kvælstofs kredsløb
Nitrogen er vigtig for en plantes vækst, men de fleste planter kan kun udnytte det når det findes som ammonium eller nitrat. Kun bælgfrugter (idet de lever i symbiose med en bakterie) og cyanobakterier kan optage kvælstof (N2) fra luften.
Mange dyr udskiller urinstof i deres urin. Mikroorganismer i jorden lever af dyrs urin, idet de producerer urease, som kan omdanne urinstof til ammoniak, der uden videre kan bruges af planter. Det er i denne del af kvælstofs kredsløb man finder processerne hvor nitrogen fra proteiner og andre nitrogenholdige organiske forbindelser bliver genbrugt.
Øvelsen
Ved denne øvelse kan elever måle aktiviteten af enzym i en plantes frø. Når substratet (urinstof) er til stede, vil urease nedbryde det til carbondioxid og ammoniak. Når ammoniak opløses i vand vil pH stige, dette kan ses ved hjælp af rødkålsindikatoren. I eksperimentet vil eleverne se, at det er nødvendigt med både et substrat (urinstof) og et enzym (urease) for at der kan dannes ammoniak. Eleverne vil dermed se at pH-værdien øges når enzymet virker.
Rødkålssaft – en god pH indikator
I denne øvelse benytter vi rødkålssaft som pH indikator. Det indeholder anthocyaniner. Strukturen og farven (i opløsninger) af disse forbindelser er afhængig af pH-værdien. Ved pH 7 er opløsningen violet/blå; i surt miljø bliver de røde. Når pH er over 7 og opløsningen er mere basisk, vil rødkålssaften blive grøn. Disse farveskift er reversible – se hvad der sker når du tilføjer først citronsyre og derefter natron (natriumhydrogencarbonat).
Materialer og udstyr
For hver elev eller gruppe af elever:
- 20 ml 10% opløsning af urinstof-gødning (en fast gødning bestående af rent urinstof)
- 5 ml 10% opløsning af citronsyre (eller anden opløsning med lav pH)
- 5 ml 10% opløsning af natriumhydrogencarbonat (NaHCO3) (eller anden opløsning med høj pH)
- 40 ml rødkålsindikator, fremstillet som beskrevet nedenfor
- 10 ml soyabønne-ekstrakt, fremstillet som beskrevet nedenfor (fra 1 g tørrede soyabønner)
- 10 ml demineraliseret vand
- Pasteur pipetter eller plastiksugerør, til at overføre opløsninger med
- 6 reagensglas og stativ
Til fremstillingen af soyabønne-ekstraktet skal man bruge kogende vand, en blender, et kaffefilter og en tragt.
Tid
Eksperimentet kan gennemføres på 30 minutter.
Soysbønne-suspensionen og rødkålsindikatoren kan fremstilles i forvejen eller fremstillingen kan laves fælles som demonstration undervejs i forsøget. Dette tager kun ca. ti minuter, men soyabønnerne skal stå i blød mindst en time inden de skal bruges.
Reaktionen mellem soyabønne-ureasen og urinstof tager også ca. ti minutter.
Fremstilling
Rødkålsindikator
- Skær to store rødkålsblade i strimler og placer dem i et bægerglas (eller en anden beholder der kan tåle varme). Hæld 200 ml kogende vand på således at rødkålen er fuldstændig dækket.
- Efter 5 min dekanteres væsken og sættes til afkøling.
- Smid bladende ud.
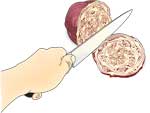

Soyabønne-ekstrakt der indeholder urease
- Blød soyabønnerne op i vand i mindst 1 time (helst natten over).
- Blend de udblødte sojabønner, sammen med ca. 10 ml vand pr. gram tørre sojabønner, i ca. 5 min indtil blandingen er ensartet (man kan bruge vandet, som man har blødt dem op i).
- Filtrer soyabønnemosen gennem kaffefiltret.
- Opsaml og gem filtratet, som indeholder urease.

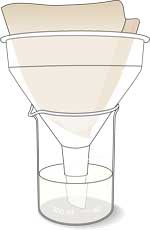

Undersøgelse
Mængderne nedenfor er tilpasset standard reagensglas (~10 ml).
Lad først eleverne undersøge hvordan farven af rødkålssaften afhænger af pH.
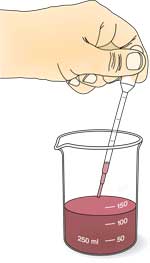
- Hæld 3 ml rødkålsindikator i tre reagensglas.
- Tilsæt 2 dråber af citronsyre-opløsningen til det første glas. Bland og noter farveændringen. Skyl pipetten med vand efter hver tilsætning.
- Add 2 drops of sodium bicarbonate solution to the second test tube. Mix and observe the colour change.
- Tilsæt 2 dråber demineraliseret vand til det tredje reagensglas. Bland og noter farveændringen.
- Sammenlign farverne i de tre reagensglas. Sæt dem til side – de bruges senere som reference.
Derefter undersøges ureasens virkning på opløsningen af urinstof.
- Hæld 2 ml rødkålsindikator i tre nye reagensglas.
- Bland 2 ml urinsstof-opløsning i to af disse glas. Noter farven.
- Tilsæt 2 ml af soyabønne-suspensionen til det sidste glas og til et af de to med urinstof.
- Sammenlign farverne og duftene fra blandingerne i de tre reagensglas. Gentag observationen efter 3 min.
Fortolkning
Rødkålsindikatoren bliver grøn når pH stiger. Dette farveskift, sammen med en duft af ammoniak, kan ses i reagensglassset der indeholder både enzym og substrat. I de reagensglas, der kun indeholder enten substrat eller enzym, forbliver pH stabil, og rødkålsindikatoren forbliver violet.
Sikkerhed
Omkring 1% af alle børn er allergiske overfor soyabønne-ekstrakt (see McGee, 2004). Læren bør spørge om nogle af eleverne er allergiske over for sojabønne-ekstrakt før forsøget.
Videre undersøgelser
Man kan udføre yderligere eksperimenter for at undersøge faktorer der har indflydelse på enzymaktiviteten (for eksempel temperatur, pH og koncentrationerne af enzym, substrat og produkt).
Tak
Dette eksperiment er udviklet af Anna Lorenc for Volvox projektet, som er fiancieret via “The Sixth Framework Programme” under Europakommisionen.
Volvox projektet
References
- Ainsworth C (2008) Locking the cradle. Science in School 8: 25-28. www.scienceinschool.org/2008/issue8/rabies
- McGee H (2004) On food and cooking. London, UK: Hodder & Stoughton. ISBN: 0340831499
Review
Enzymaktivitet bliver ofte undersøgt ved hjælp af amylases virkning på stivelse, hvilket hænger godt sammen med emner som fordøjelse og kost. Den simple metode, som præsenteres her, giver en god afveksling og samtidig en sammenhæng med kvælstofs kredsløb, som ellers kan være svært for elever at forstå. Ideen med at bruge en naturlig indikator som eleverne selv kan isolere gør undervisningen sjovere. Eleverne kan desuden også dufte reaktionsproduktet idet der frigives ammoniak! Faktorer der indvirker på enzymeaktiviteten kan undersøges i et gruppearbejde og efterfølgende diskuteres i plenum.
Artiklen kan benyttes for at teste elevernes forståelse, idet man stiller spørgsmål som:
- Hvorfor putter man rødkålsbladende i kogende vand?
- Hvilken farve vil indikatoren få hvis der er ammoniak tilstede i opløsningen?
- Beskriv hvad du ville se, hvis vi brugte kogt sojabønne-ekstrakt, og forklar hvorfor.
- Hvilket af reagensglassene er ‘kontrol’ eksperimentet? Forklar hvad dette betyder og hvad du vil forvente at observere i dette glas.
Shelley Goodman, Storbritannien





