Química clàssica: trobar la fórmula empírica Teach article
Presencieu una reacció química espectacular i preneu algunes mesures acurades per obtenir la fórmula empírica d’un compost.
Cada compost químic té una fórmula química. De fet, hi ha diferents tipus de fórmules químiques per a qualsevol compost (figura 1). Potser el tipus més familiar és la fórmula molecular (com ara H2O per a l’aigua i CO2 per al diòxid de carboni), que ens indica el nombre dels diferents àtoms en cada molècula. Les fórmules estructurals van un pas més enllà, mostrant com estan enllaçats els àtoms dins la molècula, fet especialment important en els compostos orgànics.
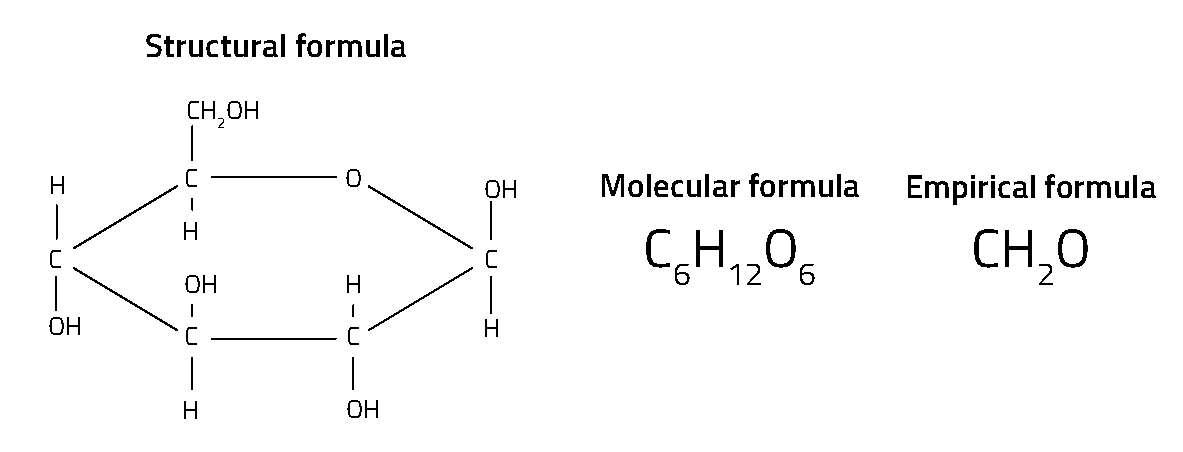
El tipus de fórmula més simple – anomenada fórmula empírica – mostra només la relació entre els diferents àtoms. Per exemple, mentre que la fórmula molecular per a la glucosa és C6H12O6 , la seva fórmula empírica és CH2O – mostrant que hi ha el doble d’àtoms d’hidrogen que d’àtoms de carboni o d’oxigen, però no el nombre real d’àtoms en una molècula o com estan disposats. Aquestes senzilles fórmules, basades en relacions, van ser desenvolupades pels primers químics al segle XVIII. Es coneixen com a fórmules “empíriques” perquè la relació entre el nombre d’àtoms d’un compost es pot trobar mitjançant mètodes experimentals tradicionals d’anàlisi química.

Caroline Evans
Avui, l’obtenció experimental d’una fórmula empírica forma part dels cursos de química arreu del món. És també el primer pas per obtenir la fórmula química d’un compost desconegut, convertint-la en una eina útil en l’anàlisi química. La demostració clàssica a l’escola consisteix a escalfar magnesi en un gresol per obtenir òxid de magnesi – una avorrida pols blanca. En aquest article es descriu una alternativa molt més emocionant: una espectacular reacció entre estany i iode, produint un vapor de color morat fort i cristalls taronja brillant a mesura que avança la reacció.
L’objectiu de l’experiment és calcular la relació entre àtoms d’estany i iode en el iodur d’estany. Això es fa sintetitzant aquest compost i mesurant amb precisió la massa dels reactius al començament de l’experiment i l’estany que sobra al final. L’experiment fa servir diverses tècniques, inclòs el muntatge d’un condensador de reflux i l’ús de dissolvents orgànics per a l’extracció. L’exercici pràctic, a més de tractar d’obtenir la fórmula empírica, enllaça l’experiment amb temes més teòrics de química, com els avantatges d’utilitzar un reactiu en excés, la síntesi de compostos a partir dels seus elements i com l’enllaç es pot relacionar amb la solubilitat. És també una aplicació molt clara de la llei de conservació de la massa, que és un principi fonamental en tota la química (i la ciència en general).
Segons el nombre de campanes de gasos disponibles a la vostra aula, els estudiants poden dur a terme l’experiment ells mateixos, però també és adequat com a demostració del professor. L’experiment dura unes dues hores i funciona millor en una classe doble, però també és possible dividir-la en dues classes. És més adequat per a estudiants de 16 a 18 anys, però també es pot utilitzar com a activitat d’ampliació per a alumnes de 14 a 16 anys.
Materials
El professor (o cada grup d’estudiants) necessitarà els següents:
- 3 g de iode
- 5 g d’estany metàl·lic, en peces quadrades no més grans d’1 cm
- 60 mL de ciclohexà
- Propanona
- Matràs de fons rodó de 250 mL (per exemple Quickfit®)
- Proveta de 100 mL
- Dos vasos de precipitats de 250 mL
- Pinces
- Manta calefactora
- Condensador de reflux
- Subministrament d’aigua
- 2 fulls grans de paper de filtre
- Balança de precisió
- Plataforma d’elevació (opcional)
Nota de seguretat
Els estudiants han de portar una bata de laboratori, guants i ulleres de seguretat. El iode sòlid és corrosiu i pot tacar la pell, per la qual cosa s’han de portar guants. L’experiment s’ha de dur a terme en una campana de gasos. Com que el vapor de iode és tòxic, assegureu-vos que el vapor morat no pugi més d’un terç de l’alçada del condensador de reflux quan s’escalfa. El ciclohexà i la propanona són altament inflamables, per la qual cosa es requereix una manta calefactora i cal tenir cura que aquests dos dissolvents estiguin allunyats de les flames. La propanona s’ha de llençar dins d’una ampolla de residus per a dissolvents. A més, els professors han de seguir les seves normes habituals de seguretat i salut.
Procediment
- Col·loqueu el matràs de fons rodó de 250 mL a la balança. Col·loqueu aproximadament 3 g de iode sòlid al matràs i anoteu amb precisió la massa afegida.
- Afegiu uns 5 g d’estany metàl·lic al matràs i anoteu amb precisió la massa d’estany utilitzada.
- Agafeu el matràs pel coll i afegiu-hi 60 mL de ciclohexà.

Pesant el iode (pas 1)
Caroline Evans
Estany i iode al matràs (pas 2)
Caroline Evans
Matràs amb ciclohexà afegit a l’estany i al iode (pas 3)
Caroline Evans - Col·loqueu el matràs en la manta calefactora. Podeu utilitzar una plataforma d’elevació que us permeti elevar i baixar el calefactor quan calgui.
- Poseu el condensador de reflux verticalment al coll del matràs, subjecteu-lo amb una pinça i connecteu-lo al subministrament d’aigua.
- Escalfeu la mescla del matràs suaument fins que comenci a bullir.
- Reduïu l’escalfor fins que la mescla bulli suaument i el vapor de iode morat no pugi més d’un terç de l’alçada del condensador.
- Continueu escalfant fins que ja no hi hagi cap rastre de vapor morat i el líquid que caigui del condensador al matràs sigui incolor. El líquid del matràs ha de ser taronja. Pot trigar fins a una hora a completar-se.
- Deixeu refredar la barreja en el matràs.

Muntatge del matràs, el condensador de reflux i la manta calefactora (passos 4-5)
Caroline Evans
El vapor de iode puja a mesura que s’escalfa la mescla (pas 7)
Caroline Evans
Es forma un líquid taronja (pas 8)
Caroline Evans - En una campana de gasos, aboqueu el líquid taronja del matràs en un vas de precipitats, vigilant que no hi caigui cap tros residual d’estany.
- Afegiu una petita quantitat de propanona al matràs de fons rodó i gireu-lo per dissoldre el iodur d’estany que encara pugui quedar al matràs amb l’excés d’estany sòlid. Decanteu amb cura els rentats de propanona en un altre vas de vidre. Repetiu aquest procés gir amb la propanona fins que la propanona que s’aboca del matràs al vas de precipitats no tingui color. Aquest pas garanteix que la massa sòlida sobrant no conté iodur d’estany taronja.
- Deixeu el vas amb el líquid taronja (pas 10) a la campana de gasos durant la nit perquè el dissolvent s’evapori, deixant que es formin uns bonics cristalls de iodur d’estany taronja. (Podreu veure això a la propera classe.)
- Transferiu l’estany no reaccionat que queda al matràs al final de l’experiment al damunt de dos grans trossos de paper de filtre. Deixeu que el paper de filtre i l’estany s’assequin a l’aire i, a continuació, peseu i anoteu la massa d’estany sobrer.
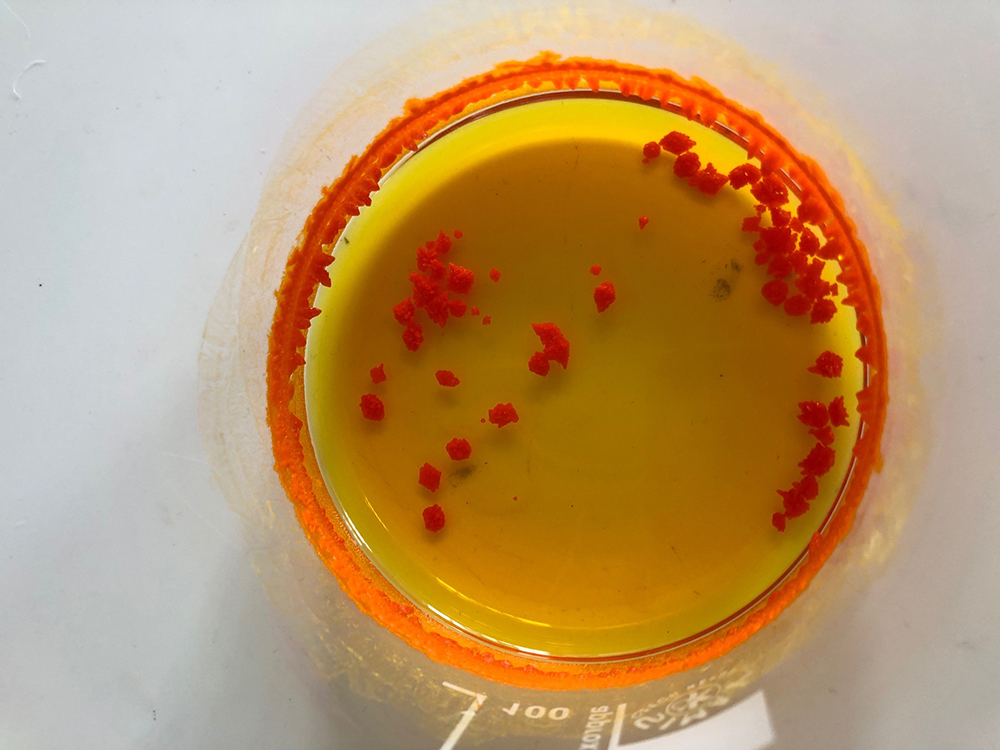
Es formen cristalls de iodur d’estany (pas 12)
Caroline Evans
Estany sobrer, assecat sobre paper de filtre (pas 13)
Caroline Evans
Determinant la fórmula empírica
Aquest experiment fa reaccionar dues substàncies (estany i iode) en la seva forma elemental per produir el compost iodur d’estany. L’estany té més d’un possible estat d’oxidació, de manera que la reacció podria produir iodur d’estany (II) (SnI2) o iodur d’ estany (IV) (SnI4). Utilitzant les dades experimentals, podem obtenir la fórmula empírica del producte, que ens dirà la relació entre l’estany i el iode. A partir d’això, podem esbrinar la identitat del compost d’estany produït.
- El primer pas és calcular les masses de iode i estany utilitzades en la reacció. Tot el iode s’utilitza en la reacció (ja que és el reactiu limitant, mentre que l’estany és en excés), de manera que podem utilitzar la massa de iode pesada al pas 1.
- Per calcular la massa d’estany utilitzada en la reacció, hem de restar la massa d’estany que queda un cop finalitzada la reacció de la massa inicial.
Estany utilitzat en la reacció = massa inicial (pas 2) menys massa sobrant (pas 13)
- Ara hem de convertir les masses a mols, per trobar la quantitat d’àtoms d’estany i iode utilitzats en la reacció. Per fer-ho, dividim cada valor de massa (dels passos 14 i 15) per la massa atòmica relativa (Ar) de l’element. Les respostes que obtindrem ens diran la quantitat de substància de cada element utilitzada en la reacció (i, per tant, del compost final).
- Per trobar la fórmula empírica del iodur d’estany, hem de trobar el nombre de mols de iode utilitzats per cada mol d’estany. Aquí, dividim ambdues respostes del pas 16 pel nombre de mols d’estany utilitzats (ja que això ens dirà quants mols de iode es combinen amb un mol d’estany). És possible que hàgiu d’arrodonir lleugerament aquesta relació per formar nombres enters simples: per exemple, una proporció d’estany i iode d’1:3.6 es pot arrodonir a 1:4.
- Finalment, podeu escriure la fórmula empírica: per exemple, una proporció d’1:4 significa que la fórmula empírica és SnI4 . Quina fórmula empírica heu trobat?
Discussió
Aquesta activitat pot produir bons resultats si es realitza amb cura, amb valors que haurien d’estar molt propers a 1:4 (com a relació entre estany i iode). Això porta a SnI4 com a fórmula empírica del iodur d’estany.
En general, s’acostumen a obtenir valors entre 1:3,2 i 1:3,8. Com que els estats d’oxidació comuns de l’estany són +2 i +4, cap estaria d’acord amb un resultat experimental amb una proporció propera a 1:3. Tot i això, aquests valors poden obrir una discussió sobre les fonts d’error experimental i sobre la importància de la precisió.
Fonts d’error en mesures experimentals
Després de l’experiment, demaneu a tots els estudiants que pensin en possibles fonts d’error. Quin efecte pot tenir cadascuna de les següents fonts en els resultats finals?
- Precisió de la balança utilitzada
- Reacció incompleta del iode
- Pèrdua de vapor de iode en el condensador
- Rentar malament l’estany sobrer
- Pèrdua d’estany mentre es renta amb propanona
- Assecat incomplet de l’estany abans de determinar-ne la massa
La taula 1 resumeix l’efecte de cadascuna d’aquestes fonts d’error en l’experiment i sobre el resultat final, és a dir, com canvia cadascuna el valor de x en la fórmula empírica SnIx.
| Error | Efecte sobre: la massa d’estany | Efecte sobre: la massa d’estany que ha reaccionat (massa inicial menys massa sobrera) | Efecte sobre: valor de x (a SnIx) |
|---|---|---|---|
| Reacció incompleta del iode | Augmenta, ja que no tot l’estany reacciona | Disminueix | Augmenta |
| Pèrdua d’estany sobrer mentre es renta amb propanona | Disminueix | Augmenta | Disminueix |
| Assecat incomplet de l’estany sobrer | Augmenta, afegint-hi massa addicional de dissolvent | Disminueix | Augmenta |
| Rentar malament l’estany sobrer | Augmenta a mesura que s’afegeix iodur d’estany a la massa d’estany sobrer | Disminueix | Augmenta |
| Pèrdua de vapor de iode en el condensador | Augmenta, ja que no tot l’estany ha pogut reaccionar | Disminueix | Augmenta |
Ampliació de la discussió: solubilitat i enllaç
Aquest experiment també ofereix una oportunitat per parlar de com l’enllaç està relacionat amb la solubilitat. El iode i el iodur d’estany es dissolen en dissolvents no polars (ciclohexà i propanona), però no en aigua, mentre que l’estany és un metall i és insoluble en ciclohexà, propanona i aigua. Amb aquesta informació, els vostres estudiants poden treure conclusions sobre l’enllaç més probable en aquestes substàncies?
Agraïments
L’autora voldria donar les gràcies a Alan Carter, que va ser el cap de química del Wellington College (Berkshire, Regne Unit) fins al 2004 i que va crear l’experiència inicial que va inspirar aquest article.
Resources
- Obteniu més informació sobre els estats d’oxidació de l’estany al lloc Chemguide website.
- Obteniu informació sobre un experiment alternatiu per deduir una fórmula empírica, aquesta vegada per a l’òxid de coure (II), al lloc Royal Society of Chemistry website.
Review
En aquest article es descriu un espectacular experiment per a obtenir la fórmula empírica d’un compost obtingut a partir dels seus elements. Aquest exercici pràctic proporciona als estudiants l’oportunitat d’anar més enllà dels exercicis numèrics quan es treballa amb fórmules químiques.
L’experiment és adequat per als estudiants més grans de química que estudien química analítica. Fa servir una àmplia gamma de tècniques experimentals i pot ser utilitzat com a punt de partida per discutir les diferents fonts d’error en les mesures experimentals. També pot proporcionar una base per a altres temes clau, incloent la relació entre l’enllaç i la solubilitat.
Tots els materials necessaris es poden obtenir fàcilment i les instruccions són fàcils de seguir, fent que les activitats dels estudiants puguin realitzar-se en grups.
Mireia Güell Serra, professora de química i matemàtiques, INS Cassà de la Selva, Espanya





