Supporting materials
Uspořádání vaší fermentace (Word)
Uspořádání vaší fermentace (Pdf)
Download
Download this article as a PDF

Přeložila Zdena Tejkalová. Evropské země produkují více než polovinu světového množství vína-a také ho hodně vypijí! Tyto praktické aktivity pro školy odhalí vědu v pozadí dokonalého vína.

Věk, od kdy je legální požívat alkohol, se v jednotlivých zemích liší, ale většina učitelů by se shodla na tom, že pití vína v hodinách chemie je nevhodné (a potenciálně nebezpečné!). Nicméně výroba a analýza vína ve škole může být zábavná i edukativní. Následující aktivity, vytvořené ve vědeckém centru Experimentaw1, umožní studentům ve věku 15-18 let stát se na den vinaři, používat analytické metody k objevování změn, které se dějí během procesu výroby vína.
Víno se vyrábí kvašením šťávy z hroznů (s mimořádně vysokým obsahem cukru) pomocí speciálních kvasinek. Cukr je za anaerobních podmínek přeměňován na etanol a oxid uhličitý:
C6H12O6 + 2 ADP + 2 Pi = 2 C2H5OH + 2 CO2 + 2 AT
Experimentaw1 v Heilbronnu je největší neformální výukové a interaktivní vědecké centrum v jižním Německu. Kromě interaktivních výstav a vědecké zahrady, nabízí Experimenta více než 30 laboratorních programů pro školní skupiny i jednotlivce od mateřských až po střední školy. Tyto programy jsou zaměřené na technologii a všechny přírodní vědy, stejně jako na vzdělávání učitelů.

Tři hlavní faktory, které určují kvalitu výsledného produktu jsou sladkost, obsah alkoholu a obsah kyselin. S využitím metod, jež jsou standardně používané komerčními vinnými laboratořemi, následující tři aktivity, uskutečnitelné i ve školních laboratořích, ukáží, jak kvalita výchozí hroznové šťávy a moštu (nakvašená hroznová šťáva) ovlivní výsledný produkt. Každá aktivita zabere cca 20-30 minut.

Další čtyři aktivity si můžete stáhnout zdew2:

K nahrazení moštu, využívaného v těchto experimentech, stačí jednoduše zkvasit hroznovou šťávu, alespoň den předem; použijte červenou hroznovou šťávu (např. ze supermarketu). Dále budete potřebovat základní chemické laboratorní vybavení a vínoměr na měření obsahu alkoholu, pyknometr (také známý jako nádoba s přesním objemem) a refraktometr. Návod k fermentaci si můžete stáhnoutw2.

Sladkost vína se učí podle množství cukru, které zbyde po fermentaci, společně s celkovou kyselostí vína. Suché víno má obsah cukru maximálně 9 g/l a kyselost minimálně o 2 g/l nižší než obsah cukru. Středně suché víno obsahuje 9 – 18 g/l cukru a kyselost by neměla být o více než 10 g/l nižší než obsahu cukru. Sladké víno má obsah cukru 18 – 45 g/l. Pro zajištění správné rovnováhy cukru, kyselosti a alkoholu ve vyrobeném vínu je důležité stanovit výchozí obsah cukru, v případě potřeby je možné omezené množství cukru přidat během kvašení.
Vyšší hustota moštu (v porovnání s vodou) je dána především zkvasitelnými cukry. Měření hustoty či refraktometrie mohou být využity ke zjištění obsahu cukru, který se v Německu vyjadřuje jako váha moštu a jeho jednotkou je Oechsle (°Oe). V anglofonních zemích se obsah cukru určuje pomocí jednotky Brix (°Bx), která udává koncentraci rozpuštěného cukru v hmotnostních procentech (wt %).
Hmotnost moštu je počítána následovně:
hmotnost moštu = (hustota – 1) x 1000
Hmotnost moštu je měřena v °Oe a hustota v g/l.
Hrubým odhadem 1°Oe odpovídá množství cukru 2.37 g/l (t. j. okolo 0.237 °Bx). Proto může být obsah cukru odhadnut následovně:
koncentrace cukru = hmotnost moštu x 2.37
Kde koncentrace cukru měřena je v g/l.
Zkvašením veškerého zkvasitelného cukru v roztoku o 100 °Oe (koncentrace cukru 237 g/l či 23.7 °Bx) lze získat přibližně 100 g/l etanolu (10 hmotnostních %). Protože etanol má hustotu 0.79 g/ml, lze údaj převést na 12.67 objemových %. Takto:
koncentrace alkoholu (v objemových %) = koncentrace alkoholu (v g/l) Í 0.1267
Množství cukru v hroznové šťávě ovlivní jak obsah alkoholu, tak sladkost připraveného vína. Během této aktivity využijete index lomu k určení obsahu cukru.
Refrakce je změna směru světla při průchodu z jednoho prostředí do jiného (např. ze vzduchu do vody). Rozptylová schopnost roztoku se mění v závislosti na rostoucí koncentraci rozpuštěných látek. Refraktometr využívá tohoto principu ke zjištění koncentrace rozpuštěných částic v roztoku. Ve víně se měří částice sacharózy.
Většina ručních refraktometrů určuje koncentraci rozpuštěné látky buď v Brixech (°Bx), což je definováno jako obsah sacharózy, nebo v Oechslech (°Oe). 20% roztok sacharózy ve vodě odpovídá 20 °Bx. Oechsle může být převeden na přibližnou hodnotu v jednotkách Brix vynásobením 0,237.

| 20% sacharóza (hm. %) | Hroznová šťáva | |
|---|---|---|
| Hmotnost moštu (°Oe) | ||
| Obsah cukru (°Bx) | ||
| Potenciální zisk alkoholu (objemová %) |
Množství alkoholu získané kvašením závisí na obsahu cukru v hroznové šťávě a na alkoholové tolerance kmene kvasinek: většina kvasinek toleruje do obsahu 16 %. Množství alkoholu může být rychle a přesně změřeno s využitím vínoměru, jednoduchého zařízení vyvinutého pro domácí výrobce vína. Je založen na principu snižování povrchového napětí s rostoucím množstvím alkoholu.
Během této aktivity budete měřit obsah alkoholu ve svém moštu.
| Obsah alkoholu (obj. %) | |
|---|---|
| Mošt (filtrovaný) | |
| Vino |
Poznámka: Obsah alkoholu v moštu je pravděpodobně mnohem nižší než ve víně. To může být způsobeno nedokončenou fermentací. To může také znamenat, že zbývající cukr zvýšil povrchové napětí a ovlivňuje odečet.

Ovocné džusy mohou, v závislosti na typu ovoce, obsahovat odlišná množství několika různých kyselin včetně vinné, jablečné, citronové a oxalové. Převládající kyselinou ve víně je kyselina vinná, jejíž pH se pohybuje mezi 3-4. Ovšem díky komplexní směsici různých kyselin a bází, proteinů a solí, celkový obsah kyseliny ve víně nemůže být odhadu pouze z hodnoty pH. Namísto toho se zjišťuje titrací pH na neutrální a vyjádřením jako totální ekvivalent kyseliny vinné v g/l. Obsah kyseliny ve víně se obvykle pohybuje mezi 4-8.5 g/l, ale může být až 15 g/l. Vždy musí být posuzována v souvislosti s množstvím zbytkového cukru (viz „Stanovení obsahu cukru“).
Kyselina vinná (molární hmotnost 150) je diprotická kyselina (obsahuje v molekule dva vodíkové atomy, které mohou ve vodě disociovat), která může být neutralizována hydroxidem sodným. Protože 1 mol NaOH zneutralizuje 0.5 molu kyseliny vinné (75 g/l), 1 ml 0.1M NaOH zneutralizuje 7.5 mg kyseliny vinné.
HOOC-CH(OH)-CH(OH)-COOH + 2NaOH → Na+-OOC-CH(OH)-CH(OH)-COO– Na+ + 2H2O
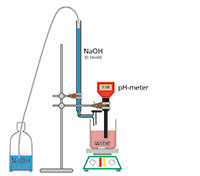
Všechna vína obsahují určité množství kyseliny. Výrobci vína se zajímají o celkovou kyselost, způsobenou především kyselinou vinnou. Celková kyselost je určována titrací zředěným hydroxidem sodným.
Pro každý vzorek (mošt či víno):
Příklad: Použili jsme 14 ml 0.1 M NaOH k neutralizaci 10 ml roztoku. Koncentrace je potom (14 x 7.5 mg/ml x 100) = 10.5 g/l kyseliny.
| Mošt | Vino | |
|---|---|---|
| pH na začátku | ||
| Počáteční objem NaOH (ml) | ||
| Konečný objem NaOH (ml) | ||
| Použitý objem NaOH (ml) | ||
| Koncentrace kyseliny (g/l) |
Používejte ochranné brýle a rukavice. Viz všeobecné zásady bezpečnosti.

V aktivitách 1 – 3 jste analyzovali tři hlavní faktory, které ovlivňují kvalitu konečného produktu: sladkost, obsah alkoholu a obsah kyselin. Nyní je čas ohodnotit váš produkt.
Autor by rád poděkoval vinné laboratoři Pfäffle GmbH v Heilbronnu, Německo za podporu v průběhu vývoje aktivit. Také by rád poděkoval především Christine Dietrich a Karsten Wiese z Vysoké školy pedagogické v Heilbronnu za jejich spolupráci.
Schmitt A (1975) Aktuelle Weinanalytik, Ein Leitfaden für die Praxis. Germany: Heller Chemie. ISBN: 978-3-9800498-3-2
Uspořádání vaší fermentace (Word)
Uspořádání vaší fermentace (Pdf)
Download this article as a PDF