Supporting materials
Achtergrondinformatie over koolstofdioxide (Word)
Achtergrondinformatie over koolstofdioxide (Pdf)
Verhalen over koolstofdioxide (Word)
Verhalen over koolstofdioxide (Pdf)
Download
Download this article as a PDF

Vertaald door Piet Das. Marlene Rau presenteert hier een aantal bruisende en bubbelende activiteiten met koolstofdioxide, ontwikkeld door “Chemol” and “Science on the Shelves”.

Koolstofdioxide (CO2) is niet alleen een van de belangrijkste broeikasgassen, maar het is overal om ons heen te vinden: in de lucht (0,0388 vol%)die we inademen; in de lucht die we uitademen (4 vol%); in frisdrank met prik; in cake die rijst dankzij de CO2 die wordt geproduceerd door bakpoeder; en wanneer organische stoffen als kaarsvet, papier, hout of benzine verbrand worden. In vloeibare vorm wordt het gebruikt in brandblussers en als koelmiddel in de voedingsindustrie (bijvoorbeeld om ijsjes op te slaan en te vervoeren).
CO2 kan in hoge concentraties gevaarlijk worden voor mensen en andere dieren, maar het is ook een bron voor leven: bij de fotosynthese gebruiken planten CO2 en licht om suiker, zetmeel, vetten en eiwitten te produceren en ook zuurstof die we nodig hebben om te overleven.
De hierna volgende activiteiten van Chemolw1 and Science on the Shelvesw2 (zie box) zijn een introductie voor basisschoolkinderen tot dit belangrijke gas. Om de activiteiten te ondersteunen is meer achtergrondinformatie over de chemie, natuurkundig belang, opsporen en voorkomen van CO2 beschikbaar in de extra blokkenw3.

Let op: de hoeveelheden koolstofdioxide die in deze activiteiten geproduceerd worden zijn niet hoog genoeg om gevaarlijk te zijn.
Als je water bij bruistabletten of bakpoeder doet ontstaan er bubbels: er wordt een gas gevormd. Je kunt dit gas gebruiken om een ballon op te blazen zonder dat je zelf hoeft op te blazen. Watvoor gas is dat? Laten we het opvangen en analyseren.

De eerste zes stappen zijn bij beide activiteiten gelijk – daarna heb je twee mogelijkheden voor het vervolg.
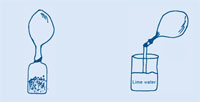
Als je kalkwater in je ogen krijgt moet je ze onmiddellijk uitspoelen met water. Lees ook de algemene veiligheidsvoorschriften.
De kalkwater test om CO2 aan te tonen werd ontwikkeld door de scheikundige Joseph Black (1728 – 1799). Zowel cement als mortel bevatten calciumhydroxide (Ca(OH)2). Als CO2 bij de oplossing van Ca(OH)2, gedaan wordt, ontstaan erg kleine calciumcarbonaat (CaCO3) deeltjes; die maken het kalkwater troebel.
Waar kwam onze CO2 vandaan? Zowel bakpoeder als bruistabletten bevatten natriumbicarbonaat (NaHCO3) en een vast zuur (zoals citroenzuurkristallen of monocalciumfosfaat). Natriumbicarbonaat en het zuur reageren met elkaar door het contact met het water, waarbij ze uiteindelijk water en CO2. vormen. Dit gas vormt de belletjes als de bruistablet oplost; het is ook de stof die een cake laat rijzen.
De kaars zou moeten stoppen met branden omdat het gas (CO2) de vlam zal doven.
Weer wordt de vlam gedoofd, waarbij is aangetoond dat we in staat zijn om het gas van de ene beker in een ander te gieten, alsof het een vloeistof was. Dit toont aan dat CO2 zwaarder dan lucht is.
Chemolw1 is een project van de universiteit van Oldenburg, Duitsland, om basisschoolkinderen met scheikunde in contact te brengen. Het team, waartoe ook stagiaires horen en dat geleid wordt door dr. Julia Michaelis, biedt workshops voor kinderen aan met als onderwerp vuur, aarde, lucht en water en geeft ook trainingen aan basisschooldocenten.
Verdere Chemol activiteiten met koolstofdioxide behelzen het bouwen van je eigen brandblusapparaat op basis van CO2 experimenteren met koolzuurhoudende dranken, meten hoeveel gas geproduceerd wordt uit een zakje bakpoeder en het testen welk effect de temperatuur heeft op de oplosbaarheid van CO2 in water. Details kun je vinden op de Chemol websitew1.
Science on the Shelves is een websitew2 die handleidingen levert voor een breed scala aan simpele science proefjes waarbij voedsel en andere supermarkt producten worden gebruikt, geschikt voor 6 tot 11 jarigen en hun docenten en ouders. Het project dat is gevestigd in de UK en gecoördineerd wordt door Dr Nigel Lowe, is een samenwerking tussen de Universiteit van York en de Engineering and Physical Sciences Research Council. Als je ideeën hebt voor geweldige experimenten: Nigel staat klaar om van je te horen.
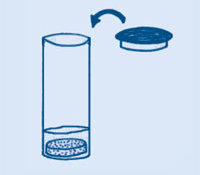
Meng 3 volle lepels natriumbicarbonaat met 1 volle lepel citroenzuurkristallen (voedselkwaliteit). Doe er om de smaak te verbeteren óf 2-4 volle lepels poedersuiker óf 1 volle lepel gelatinepoeder bij. Je “sherbet” is klaar om te proeven.
De kristallen van het citroenzuur lossen op je tong op en reageren met het natriumbicarbonaat. Dit produceert belletjes koolstofdioxidegas, dat een prikkend gevoel op je tong geeft. Om een drankje-met-prik te maken kun je de “sherbet” mengen met water.
Raketten en explosieven werken doordat er gigantische hoeveelheden gas in een korte tijd opgewekt worden. Je kunt je eigen raketten maken door citroenzuur en bakpoeder of bruistabletten te gebruiken.
Bij de volgende experimenten ontstaan snel-vliegende projectielen. Volg alle veiligheids aanwijzingen hieronder en draag een veiligheidsbril. Doe alle experimenten buiten, omdat er veel troep ontstaat. Lees ook de algemene veiligheidsvoorschriften.
Laat nooit iemand over de rand kijken als het kanon “geladen” is. Als het niet af gaat (zoals soms gebeurt als het dekseltje niet luchtdicht is), open het dan erg voorzichtig terwijl je je gezicht goed afgewend houdt.

Als de citroenzuurkristallen en het bakpoeder oplossen in water, reageren ze met elkaar waarbij ze koolstofdioxidegas produceren. Bruistabletten bevatten beide ingrediënten al (natriumbicarbonaat en een zuur) die met elkaar zullen reageren als water wordt toegevoegd. Het ontstane gas zet uit, terwijl het tegen de wand en deksel van het kanon drukt. Als de druk groter wordt dan het zwakste punt van de omringende wand (het dekseltje) zal het kanon met veel lawaai exploderen, waarbij het dekseltje tot 5 meter de lucht inschiet, terwijl het gas vrijkomt.
Houd bij hoe lang het duurt voordat het dekseltje er af gaat en experimenteer daarna met verschillende hoeveelheden. Probeer bijvoorbeeld om het dekseltje er exact na 1 minuut af te laten schieten.

Koolstofdioxide kan gevaarlijk zijn als het in voldoende hoge concentraties ophoopt. Om dit en andere gevaarlijke gassen in de werkplaats gaten te houden gebruikt EFDA-JETw4 verschillende instrumenten, zowel voor handgebruik als geïnstalleerd in gebouwen, om gassen op te sporen die de zuurstofconcentratie verlagen en zo tot verstikking kunnen leiden. De gemonitorde gassen omvatten niet alleen koolstofdioxide en andere cryogene gassen zoals helium, maar ook stikstof (wordt gebruikt om vuur te onderdrukken) zwavelhexafluoride (SF6, een isolerend gas voor elektriciteit) en de damp van koelvloeistoffen zoals Galden®. Voordat gewerkt wordt in ruimtes waar deze gassen een gevaar vormen, moet de staf het geïnstalleerde instrumentarium controleren of een meting aanvragen met handinstrumenten om er zeker van te zijn dat de lucht in de ruimte veilig is.
Koolstofdioxide is ook een mogelijk gevaarlijke stof 350 km boven het aardoppervlak – voor astronauten aan boord van het Internationale Ruimte Station (ISS), een samenwerking tussen het Europese Ruimte agentschap (ESA)w5 en andere internationale partners.
Als mensen ademen nemen ze zuurstof op en produceren ze koolstofdioxide. Ten gevolge hiervan zal in gesloten ruimtes zoals onderzeeboten, vliegtuigen en het ISS de hoeveelheid zuurstof verminderen en de hoeveelheid koolstofdioxide zich ophopen, waarbij de bemanning gevaar loopt (zoals beschreven in de film Apollo 13). De hoeveelheden van beide gassen moeten geregeld worden.
Tegenwoordig gebruikt de ISS een open benadering: ze vangen koolstofdioxide in speciale gas”vallen” op (bv lithiumhydroxide, LiOH, dat samengaat met CO2 waarbij lithiumcarbonaat en water wordt gevormd) en nemen flessen zuurstof mee van de aarde. In de toekomst zal ISS werken met een gesloten hergebruikcyclus: er wordt O2 uit CO2, gehaald waarbij aan de ene kant fysisch-chemische technieken gebruikt worden (in essentie snijden ze het zuurstofdeeltje van het koolstofdeeltje) of algen en andere planten gebruikt worden (fotosynthese).
EFDA-JET en ESA zijn leden van EIROforumw6, de uitgever van Science in School.

Geyser komt van het oude Noorse woord geysa dat gutsen betekent. Het werd voor het eerst gebruikt voor De grote Geiser, een hete bron in de Haukadalur vallei in IJsland, die kokend water tot wel 70 m hoog in de lucht spuit. Het woord wordt nu meer algemeen gebruikt voor bronnen met periodieke, jet-achtige uitbarstingen van water. Er zijn zowel geisers die kracht putten uit kokend water als ook koude geisers die kracht halen uit CO2. Het gas dat opstijgt vanuit de diepten van de aarde verzamelt zicht op de bodem van een onderaards waterreservoir en bouwt druk op. Het komt regelmatig vrij als een fontein van koud water. Er zou er wel eens een dichter bij huis kunnen zijn dan je denkt –bijvoorbeeld in Herl’any in Slowakije of in Wallenborn en bij Andernach in Duitsland.

Als er geen is, kun je er eentje zelf bouwen. Doe 200 mL water in een fles met een uittrekbaar mondstuk (bijvoorbeeld eentje waar afwasmiddel in zat; zie plaatje onder), doe er een volle theelepel natriumbicarbonaat bij en meng goed.
Doe er 35 mL afwasmiddel bij en schud weer. Doe er met behulp van een trechter snel drie volle theelepels citroenzuurkristallen bij. Draai dan zo snel mogelijk het gesloten mondstuk op de fles, schud kort en trek het mondstuk open.
Een schuimfontein van 5 m hoog schiet de lucht in. Een andere optie is wachten tot het mondstuk vanzelf open schiet. Na een tijdje zal de druk hoe dan ook ontsnapt zijn en zal de fontein stoppen. Sluit de fles door het mondstuk weer naar beneden te drukken; na ongeveer 30 seconden zal de druk weer hoog genoeg zijn om de geiser te starten. Je kunt dit meerdere keren herhalen.
Achtergrond informative over CO2 (PDF of Word® format)
Ware verhalen over de dodelijke effecten van koolstofdioxide (PDF of Word® format)
de Vries T (2002) Vitamintabletten einmal anders. Chemkon 9(3): 144-146. doi: 10.1002/1521-3730(200207)9:3<144::AID-CKON144>3.0.CO;2-K
Johnson S (2008) Planting ideas: climate-change activities for primary school. Science in School 10: 55-63. www.scienceinschool.org/2008/issue10/psiclimate
Shallcross D, Harrison T (2011) Is climate change all gloom and doom? Introducing stabilisation wedges. Science in School 20: 60-64. www.scienceinschool.org/2011/issue20/wedges
Dit artikel biedt eenvoudige manieren om natuurwetenschappelijke mysteries te ontrafelen. Het helpt iedereen natuurlijke verschijnselen en feiten te begrijpen, zowel alledaagse (ademhalen) als toevallige (vulkanische activiteit). Het kan klassen inspireren om verdere praktische proefjes te ontwikkelen. Zowel op mondiaal niveau (klimaatverandering) als op een veel lager niveau (proefjes) laat het studenten zich realiseren dat er altijd gevaren bestaan en dat het noodzakelijk is om maatregelen te nemen om deze te voorkomen.
Het artikel vind aansluiting bij gebeurtenissen die op dit moment plaatsvinden of lokale natuurlijke verschijnselen zoals vulkaanuitbarstingen in IJsland of geothermische meertjes. Het zou ook kunnen bijdragen aan een groter ecologisch bewustzijn. Je kunt vakoverstijgende verbanden leggen tussen milieutechnische en ecologische onderwerpen bij scheikunde en biologie (ademhalen), aardwetenschappen, wiskunde (maten en gewichten) en leesvaardigheid (instructies en regels)
Jongere kinderen zullen de opblaas balonnen en geisers erg leuk vinden. Ik zou de explosievere proeven bewaren voor de oudere studenten.
Maria João Lucena, Portugal