L’amidon: une structure mystérieuse Understand article
Un alignement de molécules: l’amidon. Cela paraît simple, mais ce n’est pas le cas. Dominique Cornuéjols et Serge Pérez explorent la complexité de sa structure – et montrent que son mystère est loin d’être levé.

l’aimable autorisation de
Dietmar Klement / iStockphoto
Prenez une poignée de spaghettis et letez la dans de l’eau bouillante. Les bâtonnets rigides vont rapidement devenir souples et se plier gentiment tout en gonflant. Nous tenons ce comportement des pâtes dans l’eau chaude pour acquis, mais qu’arrive-t-il exactement à la fine structure des spaghettis pour qu’elle connaisse une métamorphose aussi spectaculaire?
Un début de réponse vient de ce que les pâtes – tout comme le riz, les pommes de terre et le pain – contiennent une grande quantité d’amidon. Mais qu’est-ce que l’amidon? Produits dans les plantes par la photosynthèse du dioxide de carbone, les granules d’amidon sont composés de polymères du glucose et servent de réservoir d’énergie. Vers la fin de la saison de croissance des plantes, l’amidon s’accumule dans les petites branches des arbres, près des bourgeons. On le trouve également dans les fruits, les graines, les rhizomes et les tubercules. Les granules d’amidon sont très bien adaptés à un tel stockage à long terme, du fait de leur compacité, de leur siccité relative et de leur haute stabilité.
Cette source d’énergie essentielle n’est cependant devenue accessible aux êtres humains qu’une fois qu’ils eurent maîtrisé le feu, car les granules d’amidon brut sont si compacts qu’ils se digèrent difficilement. Pour accroître leur digestibilité, il faut cuire l’amidon: ce n’est qu’une fois chauffé qu’il devient soluble dans l’eau et comestible.
On appelle la transformation de l’amidon brut dans l’eau chaude gélatinisation: les granules gonflent et éclatent en formant une pâte. Lors du refroidissement ou d’un stockage prolongé, la pâte d’amidon s’épaissit souvent du fait d’un phénomène appelé rétrogradation. La gélatinisation et la rétrogradation, qui correspondent à des modifications structurelles des granules, affectent le comportement des composés contenant de l’amidon.
Il en résulte que l’amidon est excellent pour modifier la texture de nombreux aliments préparés pour grandes surfaces ou à la maison (par exemple comme farine de blé ou de maïs pour épaissir les sauces), et il est également utilisé depuis des siècles dans d’autres buts, y compris dans la fabrication du papier (collage), de colles ou l’empesage de tissu. De nouvelles applications de l’amidon sont en train d’émerger, comme dans des fibres diététiques à basses calories, des matériaux d’emballage biodégradables, des films minces et des matériaux thermoplastiques.
Science: une petite étape à la fois
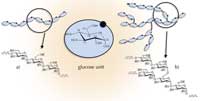
de base de l’amylose (a) et de
l’ amylopectine (b). Cliquer
sur l’image pour l’agrandir
Illustration reproduite avec
l’aimable autorisation de Serge
Pérez, ESRF
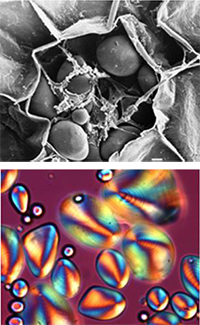
brut observé sous
microscopie électronique à
balayage b) Le granule
correspondant en lumière
polarisée
Illustration reproduite avec
l’aimable autorisation de Serge
Pérez, ESRF
L’amidon est donc largement utilisé dans l’industrie, et ce depuis des millénaires. L’étude scientifique de l’amidon a été lancée en 1833 lorsque le chimiste français Anselme Payen montra que l’amidon est composé de groupes glucosiques. Cependant, même aujourd’hui, sa biochimie et sa structure détaillée ne sont pas encore bien comprises. Au niveau moléculaire, nous savons que l’amidon naturel (tel qu’il se présente naturellement) contient deux composés distincts, l’amylose et l’amylopectine, que l’on peut isoler par fractionnement et étudier séparément.
Les deux compposants contiennent des chaînes de polymères des groupes glucosiques, mais les chaînes sont liées différemment. L’amylose est principalement constituée de groupes glucosiques linéaires avec le glucose lié par des liaisons (1-4) (Figure 1a), alors que l’amylopectine se présente sous forme d’une structure très dense, hautement ramifiée du fait de ses liaisons (1-6) (Figure 1b). L’amylopectine peut contenir jusqu’à une centaine de milliers de restes glucosiques, ce qui en fait la plus grosse bio macromolécule connue.
Les granules d’amidon naturel ont des formes et des tailles très différentes (de 0.1 à 200µm), mais ils ont tous une caractéristique commune: illuminés sous microscope en lumière polarisée, les grains d’amidon teintés à l’iode présentent une ‘croix de Malte’ distinctive (figurant en orange dans la figure 2b), ce qui indique l’existence d’un certain ordre interne. Lorsque les granules sont chauffés dans de l’eau en excès (comme lorsque l’on fait cuire des spaghettis), la croix montrée par la polarisation commence à disparaître, ce qui démontre que cet ordre moléculaire est en train d’être perturbé.
Les propriétés physiques de l’amidon – stabilité et transformations de phase, par exemple de l’état de granules à l’état de gel, ou de pâte crue cassante à pâte cuite souple – sont directement liées à cet ordre moléculaire. La compréhension de la structure détaillée de l’amidon requiert cependant des outils de recherche très avancés et des techniques comme la cristallographie aux rayons X, la microscopie électronique, la résonance magnétique nucléaire et la modélisation informatique.
Les scientifiques commencent lentement à metre en place une image de la façon dont l’amidon – qui nous est si familier – est structuré grâce à l’aide apportée par ces outils.
En partant de l’échelle nanométrique: hélices doubles, lamelles et superhélices
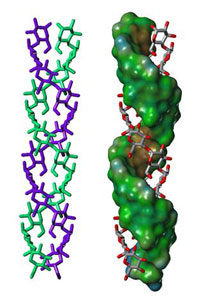
double de l’amylopectine
Illustration reproduite avec
l’aimable autorisation de Serge
Pérez, ESRF
Des recherches en diffraction aux rayons X à l’échelle nanométrique montrent que:
- L’amidon est composé de fins domaines lamellaires (d’environ 4.5 nm d’épaisseur);
- Chaque lamelle est constituée d’environ 100 hélices à double pas, consistant chacune en environ 20 unités de glucose (Figure 3);
- Les hélices doubles ont une disposition très dense à haut degré de régularité, tout comme dans un cristal (voir glossary pour les termes en italique).
(Pour une explication sur la manière dont on utilise la diffraction aux rayons X pour analyser les structures cristallines, voir Cornuéjols, 2009.)
L’étude aux rayons X corrobore les etudes sur la molécule d’amylopectine montrant que cette grosse molécule est organisée en couches cristallines d’hélices doubles (Figure 4a): les lamelles révélées par diffraction aux rayons X consistent en groupes d’hélices doubles trouvées dans les recherches biochimiques. Dans ce modèle, les points de liaison [les liaisons (1-6)] des molécules d’amylopectine sont localisées dans les régions les moins organisées (ou les plus amorphes) entre les groupes. L’amylose est enchevêtrée avec l’amylopectine (Figure 4b), mais personne ne sait exactement comment à ce jour.
Des etudes additionnelles aux rayons X, utilisant les techniques de diffraction des rayons X aux petits angles et aux grands angles (SAXS et WAXS) pour analyser l’amidon hydraté montrent que les lamelles des hélices doubles sont probablement organisées selon une structure hélicoïdale ou super hélice (Figure 5). (Pour une explication de la SAXS, voir Stanley, 2009.)
En descendant l’échelle microscopique: anneaux de croissance et globules
Les structures lamellaire et en super hélice ne donnent cependant qu’une image partielle de l’ensemble. A une échelle (microscopique) plus grande, l’on sait que les granules d’amidon sont constitués de coquilles alternativement amorphes et semi-cristallines d’une épaisseur comprise entre 100 et 800nm. On appelle ces structures des anneaux de croissance (Figure 6).
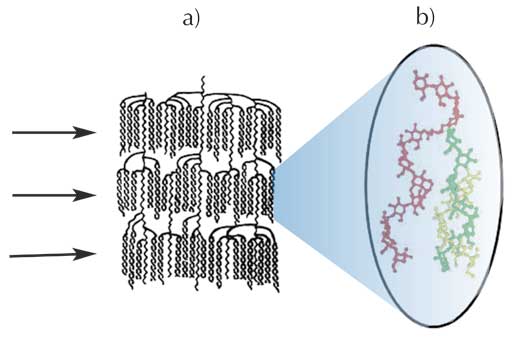
b) Enchevêtrement possible entre une chaîne d’ amylose (rouge) et des hélices doubles d’ amylopectine (vertes et jaunes)
Illustration reproduite avec l’aimable autorisation de Serge Pérez, ESRF

d’une structure en super
hélice
Illustration reproduite avec
l’aimable autorisation de Serge
Pérez, ESRF
Nous ne savons pratiquement rien des parties amorphes des anneaux de croissance. Les régions plus cristallines peuvent toutefois être étudiées par diffraction aux rayons X. Des expériences récentes utilisant les faisceaux de rayons X extrêmement focalisés d’un synchrotron (voir encadré) ont montré que les lamelles nanoscopiques sont parallèles à la surface de l’amidon à l’intérieur des régions semicristallines (Figure 7). Cela a permis aux scientifiques de faire le lien entre le petit (échelle microscopique, c’est-à-dire granules d’amidon) et le très, très petit (échelle du nanomètre, c’est-à-dire lamelles) – un lien difficile à établir dans de telles recherches de structure.
Une autre etude récente, utilisant la microscopie à force atomique pour l’examen de la surface des granules d’amidon, a montré la présence de globules à l’intérieur des anneaux de croissance. Ces globules sont plus ou moins sphériques et ont une dimension comprise entre 20 et 100nm. Jusqu’à présent, cependant, on ne sait rien de plus de ces globules.
En rassemblant toutes ces études, on peut être à peu près sûr de la structure à l’échelle nanométrique (hélices doubles formant des lamelles) et de l’existence des anneaux de croissance (alternant coquilles amorphes et semi cristallines); toutefois, pour les structures intermédiaires (super hélices et globules) les preuves sont moins convaincantes. En outre, la manière dont les super hélices, les globules et les anneaux de croissance sont en relation les uns avec les autres n’apparaît toujours pas clairement. La Figure 8 reprend les différents niveaux structurels (unités de glucose, hélices, lamelles, super hélices, globules et anneaux de croissance) du niveau moléculaire (10-9m) au niveau microscopique (10-5m).

Dès 1858, le botaniste Suisse Carl von Nägeli eut une brillante intuition lorsqu’il déclara que «Le grain d’amidon … ouvre la voie à la mise en place d’une nouvelle discipline… le mécanisme moléculaire régissant les composés organisés;». Il serait sans aucun doute surpris de voir que, plus de 150 ans plus tard, nous sommes toujours en train de nous battre pour comprendre l’architecture complexe des granules d’amidon.

a) Unité de Glucose
b) Hélice double
Haut: Image d’une fibre en diffraction de rayons X montrant une structure en hélice double (illustration reproduite avec l’aimable autorisation de Imberty et al., 1988)
Bottom: model of the double-helix structure
c) Lamelle
Haut: Image en microscopie électronique à transmissionof d’amidon hydrolysé, montrant la forme des lamelles cristallines (avec l’aimable autorisation de Angellier-Coussy et al., 2009)
Bas: modèle d’une lamelle cristalline compose d’environ 100 hélices doubles
d) Super hélice
Haut: Images de diffraction de rayons X aux petits angles (SAXS) et aux grands angles (WAXS) montrant la présence d’une structure en super hélice (avec l’aimable autorisation de Waigh et al., 2000)
Bas: le modèle,de super hélice avec un pas de 9 nm et un diamètre de 18 nm
e) Globules
Haut: Image par microscopie à force atomique de la surface typique d’un granule d’amidon (avec l’aimable autorisation de Gallant et al., 1997). Les bosses visible à la surface indiquent la présence de globules
Bas: modèle de globule. On pense que les globules sont plus petits dans les régions amorphes( region centrale) que dans les régions semi-cristallines regions (au dessus et au dessous)
f) Anneaux de croissance
Image par microscopie à transmission d’une section ultrafine d’un granule d’amidon hydrolysé, montrant les anneaux de croissance en couches alternatives de régions amorphes et semi-cristallines (avec l’aimable autorisation de I. Paintrand, CERMAV, Grenoble, France)
g) Granule
Haut: granule d’amidon observé par microscopie électronique à balayage (grande image) et le granule correspondant granule en lumière polarisée (cartouche)
Milieu: ensemble de schémas de diffraction de rayons X microfocalisés enregistrés avec un granule d’amidon montrant la distribution et l’orientation des domaines cristallins dans un granule d’amidon. Chaque schema de diffraction correspond à une surface d’environ 3 μm2 du specimen et des pas de 7 μm séparent deux schémas (avec l’aimable autorisation de Buleon et al., 2009)
Bas: section de granule d’amidon montrant l’orientation radiale des domaines cristallins (lamelles) dans un granule d’amidon
Cliquer sur l’image pour l’agrandir
Illustration reproduite avec l’aimable autorisation de Serge Pérez, ESRF
Glossaire
Amorphe: Décrit un matériau (ou partie de celui-ci) qui n’a ni ordre ni organisation.
Cristal: un cristal parfait est un matériau soliide dont les atomes, molécules ou ions constituants sont arrangés selon un schéma répétitif ordonné s’étendant dans les trois dimensions de l’espace.
Cristallin: ce qui a les proprieties du cristal, et par extension les parties caractéristiques d’un matériau ordonnées (par exemple, un groupe d’hélices doubles toutes disposées selon la même orientation de l’axe de l’hélice.
Semi cristallin: décrit un matériau (typiquement un bio polymère) avec des parties amorphes et des parties cristallines.
ESRF
L’Installation Européenne de Rayonnement Synchrotron (ESRF)w1 de Grenoble, France, est un bon exemple d’une grande installation fonctionnant jour et nuit pour le bénéfice de milliers d’utilisateurs du monde entier. Un ‘utilisateur’ est un scientifique, faisant habituellement partie d’une équipe plus importante, qui a de temps en temps besoin d’un outil puissant pour obtenir des informations sur un échantillon intéressant (polymère, cristal de protéine, fossile ou milieu en réacrion catalytique, par exemple).
L’ESRF produit des rayons X extrêmement intenses, appelés radiation synchrotron. Ces faisceaux de rayons X sont émis par des électrons de haute énergie circulant dans un grand anneau de stockage de 844 m de circonférence. Les faisceaux de rayons X sont dirigés vers les voies de circulation qui entourent l’anneau de stockage dans le hall d’expérimentation. Chacune des 42 voies de circulation de l’ESRF est spécialisée pour une technique ou un type de recherche spécifique. Les polymères intéressent un demie douzaine d’entre elles.
A l’avenir, la recherche sur les polymères bénéficiera du Partenariat sur la Matière Faiblement Condensée (incluant les polymères) nouvellement créé. L’introduction de nano faisceaux (faisceaux de rayons X de la dimension du nanomètre toujours plus focalisés) permettra bientôt une analyse structurelle encore plus fine et fera donc encore progresser l’étude des polymères, dont l’amidon.
References
- Angellier-Coussy H, et al. (2009) The molecular structure of waxy maize starch nanocrystals. Carbohydrate Research 344: 1558-1566.
 doi: 10.1016/j.carres.2009.04.002
doi: 10.1016/j.carres.2009.04.002 - Buléon A, Véronèse G, Putaux JL (2007) Self-association and crystallization of amylose. Australian Journal of Chemistry 60: 706-718. doi: 10.1071/CH07168
- Cornuéjols D (2009). Cristaux biologiques : à l’interface entre physique, chimie et biologie. Science in School 11: 70-76. http://scienceinschool.org/2009/issue11/crystallography/french
- Gallant DJ, Bouchet B, Baldwin PM (1997) Microscopy of starch: evidence of a new level of granule organization. Carbohydrate Polymers 32: 177-191. doi: 10.1016/S0144-8617(97)00008-8
- Imberty A et al. (1988) The double-helical nature of the crystalline part of A-starch. Journal of Molecular Biology 201: 365-378.
 doi: 10.1016/0022-2836(88)90144-1
doi: 10.1016/0022-2836(88)90144-1 - Stanley H (2009) Boules de plasma: comment créer le 4e état de la matière avec des micro-ondes. Science in School 12: 24-29. http://scienceinschool.org/2009/issue12/fireballs/french
- Waigh TA et al. (2000) Side-chain liquid-crystalline model for starch. Starch 53: 450-460. doi: 10.1002/1521-379X(200012)52:12<450::AID-STAR450>3.0.CO;2-5
Web References
- w1 – Pour en apprendre davantage sur l’ESRF, voir: www.esrf.eu
Resources
- Pour une presentation extensive de l’amidon, voir le site Internet des scientifiques de l’ESRF Serge Pérez et Anne Imberty ‘Amidon: structure et morphologie’: www.cermav.cnrs.fr/glyco3d/lessons/starch
- Imberty A, Pérez S (1988) A revisit to the three-dimensional structure of B-type starch. Biopolymers 27: 1205-1221. doi: 10.1002/bip.360270803
- Pérez S, Baldwin P, Gallant DJ (2009) Structural features of starch. In: Starch-Chemistry and Technology, 3rd edition. BeMiller J, Whistler R (eds.). pp149-192. New York, NY, USA: Academic Press. ISBN: 978-0127462752
- Chanzy H, et al. (2006) Morphological and structural aspects of the giant starch granules from Phajus grandifolius. Journal of Structural Biology 154(1): 100-120. doi: 10.1016./j.jsb.2005.11.007
Institutions
Review
On ne parle pas souvent de la structure de l’amidon, mais le présent article décrit la manière dont les composants de l’amidon – amylose et amylopectine – forment des niveaux structurels complexes à l’intérieur de ce polymère. On pourrait utiliser l’article comme un complément à une leçon sur la digestion ou le dosage de l’amidon. On pourrait également l’utiliser comme un exemple de l’utilisation de la technique de la diffraction des rayons X ou de la microscopie en lumière polarisée. On pourrait préparer en classe (ou comme travail à la maison) des posters sur les utilisations industrielles de l’amidon, chaque groupe prenant en charge une utilisation différente. Les méthodes industrielles de production et/ou de test de l’amidon pourraient être étudiées. On pourrait élaborer des questions sur la compréhension des phénomènes comme:
- L’amidon contient 2 composants qui sont:
- Amylase et amylopectine
- Amylose et amylopectine
- Glucose et amylase
- Glucose et amylose
- Décrire ce qu’est la gélatinisation.
- Que représentent les anneaux de croissance dans l’amidon?
- Quelle est la différence entre amylase et amylase?
- Convertir les dimensions des différents niveaux structurels à partir de 10-9 en unités plus petites, comme le micromètre ou le nanomètre.
- La diffraction des rayons X a été utilisée dans les années 1950 pour déterminer la structure d’une molécule bien connue. Laquelle?
Shelley Goodman, Royaume Uni





